XiaoMi-AI文件搜索系统
World File Search System接受者和提供者事实说明书...
Novavax COVID-19 疫苗佐剂含有由杆状病毒感染的 Sf9(秋粘虫)昆虫细胞产生的重组形式的 SARS-CoV-2 刺突蛋白和含有从皂皮树(Quillaja saponaria Molina)中提取的皂苷的 Matrix-M TM 佐剂。其他成分包括胆固醇、磷脂酰胆碱、磷酸二氢钾、氯化钾、磷酸氢二钠二水合物、氯化钠、磷酸氢二钠七水合物、磷酸二氢钠一水合物和聚山梨醇酯80。疫苗中还可能含有少量杆状病毒和昆虫细胞蛋白和DNA。
医疗服务提供者情况说明书:COVID-19 疫苗
孕妇或哺乳期妇女应于今年秋季接种 COVID-19 疫苗,以在怀孕期间提供保护并降低新生儿住院的风险。COVID-19 疫苗可在怀孕的任何阶段(即任何三个月)和哺乳期间接种。在怀孕或哺乳期间接种 COVID-19 疫苗没有安全问题。与非孕妇相比,怀孕期间感染 SARS-CoV- 2 会增加住院风险。怀孕期间感染 SARS-CoV- 2 还会增加新生儿早产和低出生体重的风险。
医疗服务提供者情况说明书
o 用于治疗 COVID-19,或:o 用于接触过 SARS-CoV-2 感染者的个体的 COVID-19 暴露后预防。•基于现有信息(包括对 PEMGARDA 的变异敏感性和全国变异频率),仅当对 PEMGARDA 易感性大幅降低的变异的全国总频率小于或等于 90% 时,PEMGARDA 才被授权使用。•对于建议接种 COVID-19 疫苗的个体,暴露前预防 PEMGARDA 不能替代疫苗接种。建议接种 COVID-19 疫苗的个体,包括可能从 COVID-19 疫苗接种中受益的中度至重度免疫功能低下个体,应接种 COVID-19 疫苗。•对于最近接种过 COVID-19 疫苗的个体,应在接种疫苗后至少 2 周注射 PEMGARDA。 • PEMGARDA 只能由根据州法律获得许可或授权开具处方的医生、高级执业注册护士和医师助理为个人患者开具。 • PEMGARDA 仅在声明存在证明授权紧急使用药物的情况期间被授权
重点:访问专业护理州外提供者和远程医疗
cms将为所有州外医疗补助提供商建立简化的筛查和入学过程。参加示范项目的国家必须为远程医疗(包括点对点咨询中的提供者)和药物收购和管理的付款,并以不少于提供者州的付款率提供付款。✔对于凭借其本国医疗委员会的良好信誉的提供者,参与州必须为提供者提供医疗许可互惠,为该州以外的患者提供全方位的远程医疗服务。✔暂时的医疗补助报销增加了强大的远程医疗服务,并获取和管理罕见疾病疗法将使参与的州整体使提供者完整。
索赔提交说明 - 提供者
清洁索赔是该计划已收到的医疗保健服务的薪酬索赔,没有缺陷或谨慎。缺陷或不当行为应包括缺乏所需的证实文件或需要特殊待遇的特定情况,以防止及时付款。与42CFR§447.45(b)相关,该术语不应包括正在调查有关该索赔的欺诈或滥用的医疗保健提供的索赔,或审查的索赔。被拒绝的索赔定义为具有无效或丢失所需的数据元素的索赔,例如提供者税收识别号或成员ID号,这些索赔将返回给提供商或电子数据互换(EDI)*源,而没有索赔处理系统中的Regis Tration。这适用于纸张或电子方式提交的索赔。拒绝的索赔并不是索赔处理系统中的重新加权,可以作为新索赔重新提交。最初因缺失或无效的数据而拒绝的索赔,必须在服务之日起的365 cal Endar天内进行纠正和重新提交。由于被拒绝的索赔被视为原始索赔,因此适用及时提交限制。
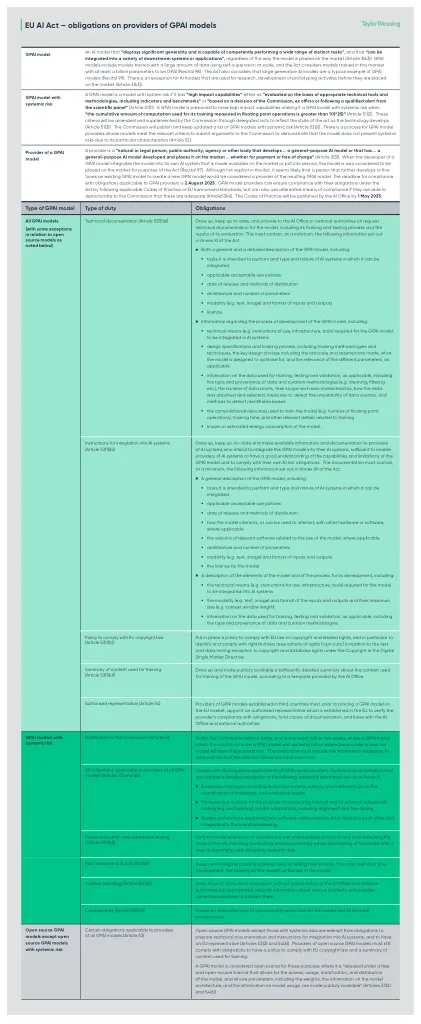
EU AI法案 - GPAI模型提供者的义务EU AI法案 - GPAI模型提供者的义务
GPAI模型是具有系统风险的模型,如果它具有“高影响力能力”,则可以“根据适当的技术工具和方法进行评估,包括指标和基准,或“基于委员会的决定,Ex Officio,或遵循来自科学小组的合格警报的决定”(第51(1)))。GPAI模型具有很高的影响能力,因此当“在浮点操作中测量的用于训练的累积计算量的累计计算量大于10(^25)”(第51(2)条)。这些标准将通过委托行为对委员会进行修改和补充,以反映技术的发展(第51(3)条)。委员会将发布并继续更新具有系统性风险的GPAI模型清单(第52(6)条)。GPAI模型提供商有一个过程,其模型符合相关标准,可以向委员会提交论据,以证明该模型由于其特定特征而不会出现系统性风险(第52条)。
免疫提供者的冷链工具包
•有一个程序,可以及时响应警报,并具有明确的角色,责任以及升级程序,以访问和审查温度并响应警报。•继续进行两次每日手动温度检查,以确保前线工作人员熟悉冰箱的正常功能,可以识别潜在的冰箱故障的预警信号,并确保疫苗在给药前未遭受冷链漏洞。•如果上周没有警报以确保未遗漏或采取适当的操作,请至少每周审查温度读数。•记录任何警报,并在争取5-疫苗冰箱温度图表上进行每周审查(请参阅附录2)。
儿童疫苗接种法规更新 - 医疗补助提供者
91320 严重急性呼吸综合征冠状病毒 2 (sarscov-2)(冠状病毒病 [Covid-19])疫苗,mRNA-LNP,刺突蛋白,30 mcg/0.3 mL 剂量,三蔗糖制剂,肌肉注射 91321 严重急性呼吸综合征冠状病毒 2 (sarscov-2)(冠状病毒病 [Covid-19])疫苗,mRNA-LNP,25 mcg/0.25 mL 剂量,肌肉注射 91322 严重急性呼吸综合征冠状病毒 2 (sarscov-2)(冠状病毒病 [Covid-19])疫苗,mRNA-LNP,50 mcg/0.5 mL 剂量,肌肉注射 疫苗和疫苗接种不属于 RHC 或 FQHC 环境中的承保服务,不单独计费,但为参加 HMK 的儿童提供的服务除外。健康蒙大拿儿童 (HMK) 由于 HMK 登记的儿童无权参加 VFC 计划,RHC 和 FQHC 提供商可以使用收入代码 0636 和疫苗程序代码向蒙大拿医疗保健计划收取疫苗费用。HMK 成员的护士专用管理访问使用收入代码 0771 报销。如果管理是核心提供商访问的一部分,则管理将与提交的面对面访问的收入代码捆绑在一起。蒙大拿州医疗补助计划成员的护士专用疫苗管理访问不可报销。联系和网站信息如有疑问,请联系:
MPOX疫苗(IMVAMUNE®)医疗保健提供者指南
imvamune®无授权在18岁以下的人中使用,但是,对于符合暴露前或暴露后疫苗接种标准的人,可能会考虑在儿科种群中使用非标签。imvamune®。尽管在这个年龄组中尚未对IMVAMUNE®的使用进行研究,但已将其作为PEP在英国MPOX上次MPOX事件中作为PEP PEP指南提供的PEP提供。临床试验已使用改良的vacinia ankara(MVA)作为具有令人放心的安全性的儿童研究了其他疫苗(TB和疟疾)。
MPOX抗病毒提供者指南
o受到严重免疫免疫功能低下的人(例如,患有当前CD4计数的HIV <200/mm 3或不受控制的病毒载荷;接受固体肿瘤或血液病恶性肿瘤的主动治疗,例如化学疗法,靶向疗法,接受免疫疗法的固体疗法;在2年内移植或接受免疫抑制作用;