XiaoMi-AI文件搜索系统
World File Search System对乌干达人对阿斯利康疫苗接种的血清阳性和耐用性的持续性,其先前或无症状的covid-19:对疫苗政策的影响
必须理解对SARS-COV-2感染和疫苗接种的免疫反应的人群特定的动态,以评估疫苗的有效性,所需的增强剂量的数量以及感染后疫苗接种的时间(1)。群豁免是打击许多传染病传播的可行方法,因为它可以允许人群内部的免疫快速发展,并防止易受伤害的病毒(2)。截至2023年1月30日,全球施用了13,168,935,724次疫苗剂量,其中5,493,549,963人至少接受一剂剂量和5,054,793,316人接受完全疫苗接种。根据截至2023年3月25日的最新数据,在乌干达服用了26,406,936次疫苗剂量。19,488,104个人至少接受了一剂疫苗,而13,043,107个人(占疫苗接种人群的67%)的13,043,107个人被完全疫苗接种(https://covid19.who.int/region/region/region/region/egion/afro/country/ug)。生成对天然免疫力的有效抗病毒抗体,疫苗需要从头细胞对SARS COV-2的反应。在初始IgM响应后,通过病毒清除率相对较快地下降,产生了类切换的抗体,主要是IgG和IgA(3)。这些类别开关的抗体负责针对SARS-COV-2(4,5)的保护性长期记忆反应,这使身体在重新暴露于感染时能够迅速反应。量化循环类开关B细胞反应的水平对于评估人口范围的免疫力和促进免疫力的策略至关重要。在该人群中的先前自然感染研究发现,急性感染并反映抗体反应幅度,类型和稳定性后,IgG滴度持续存在(6)。其他研究还表明,急性感染后数月或几年,IgG滴度保持升高且相对稳定(7,8)。在自然感染和疫苗中,抗体下降的速率已证明取决于峰值反应的大小,
罗杰·吉罗上校 (P) 美国陆军医疗司令部作战副参谋长,G-3/5/7 罗杰·吉罗上校(可晋升)是德克萨斯 A&M 大学的杰出军事毕业生。他获得了生物医学理学学士学位,并在一段时间后获得了动物科学学士学位。他在贝勒大学获得了卫生管理硕士学位,在美国陆军战争学院获得了战略研究硕士学位。 先前的职责包括:医疗排长,1-12 CAV,1CD,德克萨斯州胡德堡;执行官,C 连,第 15 FSB,1CD;S-2/3,第 15 FSB,1CD;S-4,师支援司令部,1CD;支援作战维护官,第 201 FSB,1st 1ID;指挥官,C 连,第 201 FSB,1ID,在科索沃蒙蒂思营,联合守护者行动和德国菲尔塞克玫瑰兵营;研究生,美国陆军贝勒大学卫生保健管理研究生课程,德克萨斯州萨姆休斯顿堡;卫生保健行政住院医师,第 121 医疗司令部第 18 医疗司令部,韩国首尔;第 121 医疗司令部临床支援部科长;AMEDD 上尉职业课程作战官和小组讲师,德克萨斯州萨姆休斯顿堡;第 421 军事旅执行官,威斯巴登陆军机场,并部署至伊拉克巴拉德联合基地的伊拉克自由行动;五角大楼 OTSG HQDA 作战参谋;科罗拉多州卡森堡第 43 特种部队营、第 43 支援旅指挥官;国际安全援助部队区域司令部 – 南方/第 4 步兵师 CJ4/G4 后勤助理参谋长,并部署至阿富汗坎大哈机场的持久自由行动;弗吉尼亚州福尔斯彻奇 USAMEDCOM 和 OTSG HQDA G-35 计划部科长;弗吉尼亚州五角大楼 USAMEDCOM 总部 OTSG 和 CG 外科医生总监执行官;韩国汉弗莱斯营第 2 步兵师支援旅指挥官;第 2 步兵师/韩美联合师参谋长。他之前曾担任德克萨斯州胡德堡第 1 医疗旅指挥官。Giraud 上校获得的勋章包括功绩勋章 (2 OLC)、铜星勋章 (1 OLC)、功绩服役勋章 (1 SLC)、陆军嘉奖勋章 (4 OLC)、陆军成就勋章 (2 OLC)、专家野战医疗徽章、跳伞员徽章、陆军参谋身份徽章、德国武装部队熟练徽章 (金)、圣米迦勒勋章、圣巴巴拉勋章和军事医疗功绩勋章。吉罗上校因其在医疗服务队中的专业成就而被授予美国卫生局局长“A”级熟练等级称号。
罗杰·吉罗上校 (P) 美国陆军医疗司令部作战副参谋长,G-3/5/7 罗杰·吉罗上校(可晋升)是德克萨斯 A&M 大学的杰出军事毕业生。他获得了生物医学理学学士学位,并在一段时间后获得了动物科学学士学位。他在贝勒大学获得了卫生管理硕士学位,在美国陆军战争学院获得了战略研究硕士学位。 先前的职责包括:医疗排长,1-12 CAV,1CD,德克萨斯州胡德堡;执行官,C 连,第 15 FSB,1CD;S-2/3,第 15 FSB,1CD;S-4,师支援司令部,1CD;支援作战维护官,第 201 FSB,1st 1ID;指挥官,C 连,第 201 FSB,1ID,在科索沃蒙蒂思营,联合守护者行动和德国菲尔塞克玫瑰兵营;研究生,美国陆军贝勒大学卫生保健管理研究生课程,德克萨斯州萨姆休斯顿堡;卫生保健行政住院医师,第 121 医疗司令部第 18 医疗司令部,韩国首尔;第 121 医疗司令部临床支援部科长;AMEDD 上尉职业课程作战官和小组讲师,德克萨斯州萨姆休斯顿堡;第 421 军事旅执行官,威斯巴登陆军机场,并部署至伊拉克巴拉德联合基地的伊拉克自由行动;五角大楼 OTSG HQDA 作战参谋;科罗拉多州卡森堡第 43 特种部队营、第 43 支援旅指挥官;国际安全援助部队区域司令部 – 南方/第 4 步兵师 CJ4/G4 后勤助理参谋长,并部署至阿富汗坎大哈机场的持久自由行动;弗吉尼亚州福尔斯彻奇 USAMEDCOM 和 OTSG HQDA G-35 计划部科长;弗吉尼亚州五角大楼 USAMEDCOM 总部 OTSG 和 CG 外科医生总监执行官;韩国汉弗莱斯营第 2 步兵师支援旅指挥官;第 2 步兵师/韩美联合师参谋长。他之前曾担任德克萨斯州胡德堡第 1 医疗旅指挥官。Giraud 上校获得的勋章包括功绩勋章 (2 OLC)、铜星勋章 (1 OLC)、功绩服役勋章 (1 SLC)、陆军嘉奖勋章 (4 OLC)、陆军成就勋章 (2 OLC)、专家野战医疗徽章、跳伞员徽章、陆军参谋身份徽章、德国武装部队熟练徽章 (金)、圣米迦勒勋章、圣巴巴拉勋章和军事医疗功绩勋章。吉罗上校因其在医疗服务队中的专业成就而被授予美国卫生局局长“A”级熟练等级称号。
泰德·J·科拉德准将 动员战备和陆军预备役事务办公室助理军医总监、陆军预备役医疗司令部军医总监兼副司令 泰德·J·科拉德准将于 2022 年 11 月 11 日担任美国陆军预备役医疗司令部军医总监办公室动员、战备和陆军预备役事务助理军医总监兼副指挥官。 科拉德准将通过南加州大学的 ROTC 项目被任命为少尉医疗服务团军官(正规陆军),在那里他获得了为期 4 年的 ROTC 国家奖学金和陆军 ROTC 优秀学员勋章。 他毕业时获得了生物医学和机械工程理学学士学位。 随后,他获得了科罗拉多大学科罗拉多斯普林斯分校的工商管理硕士学位,并以优异的成绩从美国陆军战争学院 (USAWC) 毕业,获得战略研究硕士学位。 他担任 USAWC 助理教授。他的军事教育包括陆军医疗部 (AMEDD) 军官基础课程;医疗后勤管理课程;战斗伤员护理课程;AMEDD 上尉职业课程;卫生服务计划、作战、情报、安全和训练课程;联合兵种演习;卫生服务人力资源经理课程;指挥和参谋学院;国防战略课程;预备役国家安全课程;旅指挥前课程;高级军官法律培训;医疗战略领导力计划;高级战略艺术计划;国家安全领导力高级经理课程和高级服务学院。BG Collard 最近担任 USAWC 预备役研究的 John Parker 主席。他还担任过军医署长的卫生人力资源陆军预备役顾问。BG Collard 拥有人事、作战和后勤背景,担任过多个领导和参谋职务。先前的职务包括加利福尼亚州圣巴勃罗西部医疗区战备支援组旅指挥官;犹他州道格拉斯堡第 807 医疗司令部(部署支援)人事副参谋长(G-1);华盛顿州刘易斯-麦科德联合基地 (JBLM) 第 6250 美国陆军医院执行官;华盛顿州刘易斯-麦科德联合基地第 7229 医疗支援部队指挥官;华盛顿州塔科马市麦迪根陆军医疗中心部队指挥官 (DIMA);阿富汗加德兹联合特遣部队 1/东部地区司令部阿富汗国家警察首席医疗导师;华盛顿州 JBLM 第一军医疗行动和计划负责人;华盛顿州塔科马市麦迪根陆军医疗中心麻醉和手术服务部行政官;华盛顿州刘易斯堡西部地区医疗司令部动员和行动官;贝塞斯达沃尔特里德陆军医疗中心医疗后勤官 (DIMA)马里兰州;第 10 特种部队组(空降)医疗后勤官,科罗拉多州卡森堡;1-8 步兵营(机械化)医疗排长;科罗拉多州卡森堡第 10 战斗支援医院训练官。BG Collard 的奖章和徽章包括功绩服务勋章(4 簇橡树叶);联合服务嘉奖勋章;陆军嘉奖勋章(1 簇橡树叶);陆军成就勋章(2 簇橡树叶);陆军预备役成就勋章(4 簇橡树叶);阿富汗战役勋章;军事杰出志愿服务勋章;武装部队预备役勋章(附带动员装置和 1 簇橡树叶);海外服务勋带;专家野战医疗徽章;战斗行动徽章和跳伞员徽章。
泰德·J·科拉德准将 动员战备和陆军预备役事务办公室助理军医总监、陆军预备役医疗司令部军医总监兼副司令 泰德·J·科拉德准将于 2022 年 11 月 11 日担任美国陆军预备役医疗司令部军医总监办公室动员、战备和陆军预备役事务助理军医总监兼副指挥官。 科拉德准将通过南加州大学的 ROTC 项目被任命为少尉医疗服务团军官(正规陆军),在那里他获得了为期 4 年的 ROTC 国家奖学金和陆军 ROTC 优秀学员勋章。 他毕业时获得了生物医学和机械工程理学学士学位。 随后,他获得了科罗拉多大学科罗拉多斯普林斯分校的工商管理硕士学位,并以优异的成绩从美国陆军战争学院 (USAWC) 毕业,获得战略研究硕士学位。 他担任 USAWC 助理教授。他的军事教育包括陆军医疗部 (AMEDD) 军官基础课程;医疗后勤管理课程;战斗伤员护理课程;AMEDD 上尉职业课程;卫生服务计划、作战、情报、安全和训练课程;联合兵种演习;卫生服务人力资源经理课程;指挥和参谋学院;国防战略课程;预备役国家安全课程;旅指挥前课程;高级军官法律培训;医疗战略领导力计划;高级战略艺术计划;国家安全领导力高级经理课程和高级服务学院。BG Collard 最近担任 USAWC 预备役研究的 John Parker 主席。他还担任过军医署长的卫生人力资源陆军预备役顾问。BG Collard 拥有人事、作战和后勤背景,担任过多个领导和参谋职务。先前的职务包括加利福尼亚州圣巴勃罗西部医疗区战备支援组旅指挥官;犹他州道格拉斯堡第 807 医疗司令部(部署支援)人事副参谋长(G-1);华盛顿州刘易斯-麦科德联合基地 (JBLM) 第 6250 美国陆军医院执行官;华盛顿州刘易斯-麦科德联合基地第 7229 医疗支援部队指挥官;华盛顿州塔科马市麦迪根陆军医疗中心部队指挥官 (DIMA);阿富汗加德兹联合特遣部队 1/东部地区司令部阿富汗国家警察首席医疗导师;华盛顿州 JBLM 第一军医疗行动和计划负责人;华盛顿州塔科马市麦迪根陆军医疗中心麻醉和手术服务部行政官;华盛顿州刘易斯堡西部地区医疗司令部动员和行动官;贝塞斯达沃尔特里德陆军医疗中心医疗后勤官 (DIMA)马里兰州;第 10 特种部队组(空降)医疗后勤官,科罗拉多州卡森堡;1-8 步兵营(机械化)医疗排长;科罗拉多州卡森堡第 10 战斗支援医院训练官。BG Collard 的奖章和徽章包括功绩服务勋章(4 簇橡树叶);联合服务嘉奖勋章;陆军嘉奖勋章(1 簇橡树叶);陆军成就勋章(2 簇橡树叶);陆军预备役成就勋章(4 簇橡树叶);阿富汗战役勋章;军事杰出志愿服务勋章;武装部队预备役勋章(附带动员装置和 1 簇橡树叶);海外服务勋带;专家野战医疗徽章;战斗行动徽章和跳伞员徽章。
先前感染,疫苗接种和杂种免疫对有症状的α,β和三角洲感染的影响
1 Infectious Disease Epidemiology Group, Weill Cornell Medicine-Qatar, Cornell University, Doha, Qatar 2 World Health Organization Collaborating Centre for Disease Epidemiology Analytics on HIV/AIDS, Sexually Transmitted Infections, and Viral Hepatitis, Weill Cornell Medicine–Qatar, Cornell University, Qatar Foundation – Education City, Doha, Qatar 3 Department of Population Health Sciences, Weill Cornell医学,康奈尔大学,纽约,纽约,美国4数学课程,数学,统计学和物理系,艺术与科学学院,卡塔尔大学,多哈,卡塔尔5号,卡塔尔5病理学系,sidra医学系,多哈,多哈,多哈,多哈,多哈6生物医学研究中心,Qatar Universiti多哈,卡塔尔
先前的SARS-COV-2感染和对Omicron变体的杂种免疫的保护有效性:系统评价和元回归
Methods For this systematic review and meta-regression, we searched for cohort, cross-sectional, and case–control studies in MEDLINE, Embase, Web of Science, ClinicalTrials.gov, the Cochrane Central Register of Controlled Trials, the WHO COVID-19 database, and Europe PubMed Central from Jan 1, 2020, to June 1, 2022, using keywords related to SARS-CoV-2, reinfection, protective有效性,先前的感染,抗体的存在和杂种免疫。主要结果是防止再感染和入院或杂交免疫力的严重疾病,相对于单独的疫苗接种的杂交免疫力以及杂交免疫相对于杂交免疫的杂交免疫力,而杂交免疫力较少。在干预措施工具的非随机研究中,评估了偏见的风险。我们使用log-odds随机效应元回归以1个月的间隔估计保护的大小。这项研究已在Prospero(CRD42022318605)注册。
NVX-COV2373疫苗作为先前接种BBIBP-CORV疫苗接种的成人的助推器的安全性和免疫原性:临时分析
1 Novavax Inc.,美国马里兰州盖瑟斯堡; 2 Insights研究组织与解决方案(IROS),阿布扎比,阿拉伯联合酋长国; 3 G42 Abu Dhabi Healthcare Abu Dhabi,阿拉伯联合酋长国; 4克利夫兰诊所阿布扎比,阿拉伯联合酋长国; 5阿拉伯联合酋长国阿布扎比的Seha Sheikh Khalifa医疗城; 6阿拉伯联合酋长国阿布扎比哈利法大学医学与健康科学学院
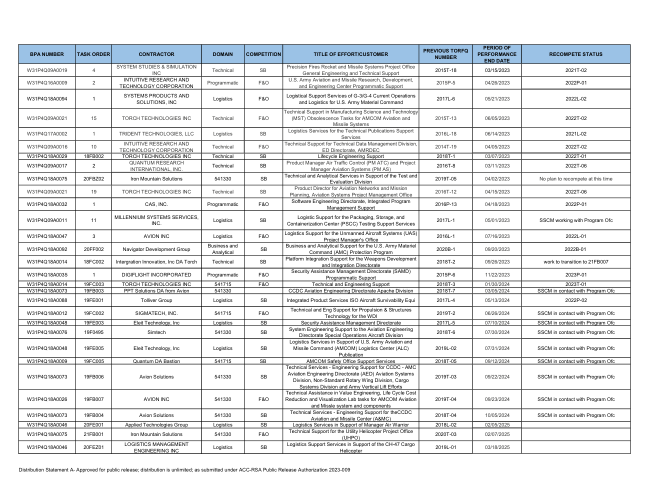
BPA 编号任务订单承包商领域竞争努力标题/客户先前 TORFQ 编号
W31P4Q18A0014 19FC003 TORCH TECHNOLOGIES INC 541715 F&O 技术和工程支持 2018T-3 01/30/2024 2023T-01 W31P4Q18A0073 19FB003 来自 Avion 的 PPT 解决方案 DA 541330 CCDC 航空工程理事会 Apache 分部 2018T-7 03/05/2024 SSCM 与项目 Ofc 联系
信用转移和对先前学习规定的认可
所有转让信用和RPL信用的评估都必须基于原始学习。转让信贷只能在最初颁发的课程的机构中获得成就。另一家机构为一门课程授予转让信用额度不足以使惠灵顿维多利亚大学为同一课程授予转会信用。转让信贷不能根据另一家机构授予的RPL信贷授予。
每周一次的基础胰岛素FC在先前用基础胰岛素治疗的2型糖尿病患者中的安全性和功效
该第2阶段的方法,44个地点(临床研究中心和医院),随机,开放标签,比较器控制的,为期32周的研究,在美国,波多黎各和墨西哥,我们招募了2型糖尿病的参与者。合格的参与者必须是成年人(年龄≥18岁),并接受了基础胰岛素和多达三种口服抗糖尿病药物的治疗。参与者被随机分配(1:1:1)到皮下给予BIF(BIF治疗组1 [BIF-A1]或2 [BIF-A2])或胰岛素depludec。随机化按国家/地区分层,基线HBA 1C值(<8·5%或≥8·5%; <69·4或≥69·4 mmol/mol),使用磺酰脲(是或否)(是或否),以及基线BMI(<30或≥30或≥30kg/m²)。使用交互式Web响应系统进行随机化方案,该系统确保了治疗组之间的平衡。BIF-A1(≤7·8 mmol/l或≤140mg/dL;每2周滴定),BIF-A2(≤6·7 mmol/L或≤120mg/dL;每4周滴定每4周)和Degludec(degludec(degludec),每2周(≤6·7 mmol/l或≤120mmol/l或≤120mg; 随机分配给BIF的患者接受了一次性加载剂量,范围为每周剂量的1·5-3倍。 第一个每周剂量是在加载剂量后1周服用的。 我们使用了Dexcom G6连续葡萄糖监测系统的间质空腹葡萄糖测量来滴定基础胰岛素。 血糖控制的主要度量是BIF的HBA 1C从基线到第32周的变化。 还将 BIF与Degludec进行了比较(非效率边缘为0·40%)。 安全人群与功效分析集相同。 Gov(NCT03736785)。每2周(≤6·7 mmol/l或≤120mmol/l或≤120mg;随机分配给BIF的患者接受了一次性加载剂量,范围为每周剂量的1·5-3倍。第一个每周剂量是在加载剂量后1周服用的。我们使用了Dexcom G6连续葡萄糖监测系统的间质空腹葡萄糖测量来滴定基础胰岛素。血糖控制的主要度量是BIF的HBA 1C从基线到第32周的变化。BIF与Degludec进行了比较(非效率边缘为0·40%)。安全人群与功效分析集相同。Gov(NCT03736785)。Gov(NCT03736785)。功效分析集由来自所有随机研究参与者的数据组成,他们根据分配的治疗方法分析了至少一剂研究药物和参与者的数据。完成的试验已在临床检查中注册。
Guselkumab的安全性,有和没有先前的肿瘤坏死因子抑制剂治疗:在牛皮癣关节炎患者的4个研究中,合并的结果
≤2年)未接受和经验丰富的银屑病关节炎患者(PSA)。方法。数据是从第2阶段和Discover-1(tnfi-never和-sanceperianthe),Discover-2(TNFi-Naïve)和宇宙(cosmos(TNFI经验体验)的研究中汇总的。活性PSA患者每4或8周将100 mg的GUS随机分配为100 mg(Q4W + Q8W =合并GUS)或安慰剂(PBO),并在第24周与GUS Q4W或Q8W进行了交叉。时间调整后的不良事件(AE)率(事件/100例患者年[PY])和临床实验室发现在PBO控制期间和研究结束期间评估(≤2年)。结果。1554例随机患者(n = 373 [GUS Q4W],664 [GUS Q8W]和517 [PBO]),1138(73.23%)的 在第24周通过第24周的AE率为220.8/100 Py(TNFI-Naïve)和251.6/100 PY(TNFI-SPACSECED)在PBO组中的GUS组中为GUS组和196.1/100 PY(TNFI-NAïve)和303.0/100 PY(TNFI-NAïve)和PY(TNFI-nemented)。 在所有经过GUS治疗的患者(包括从PBO越过的患者)中,在长期评估期间,在TNFI-NOHEVE(139.7/100 PY)和TNFI经验(174.0/100 PY)患者中,均保持了低AE率。 率/100 py的AE,导致治疗中断,严重的AE和其他感兴趣的AE,以及在PBO和GUS治疗的患者之间保持较低的肝转氨酸酶水平和中性粒细胞计数的升高和降低的中性粒细胞计数在第24周之间是一致的,无论与先前的TNFI使用,无论在研究的最终范围内均未使用,无论与先前的TNFI使用不管,无论是在先前的TNFI使用和较低的情况下,均在第24周之间进行。 结论。在第24周通过第24周的AE率为220.8/100 Py(TNFI-Naïve)和251.6/100 PY(TNFI-SPACSECED)在PBO组中的GUS组中为GUS组和196.1/100 PY(TNFI-NAïve)和303.0/100 PY(TNFI-NAïve)和PY(TNFI-nemented)。 在所有经过GUS治疗的患者(包括从PBO越过的患者)中,在长期评估期间,在TNFI-NOHEVE(139.7/100 PY)和TNFI经验(174.0/100 PY)患者中,均保持了低AE率。 率/100 py的AE,导致治疗中断,严重的AE和其他感兴趣的AE,以及在PBO和GUS治疗的患者之间保持较低的肝转氨酸酶水平和中性粒细胞计数的升高和降低的中性粒细胞计数在第24周之间是一致的,无论与先前的TNFI使用,无论在研究的最终范围内均未使用,无论与先前的TNFI使用不管,无论是在先前的TNFI使用和较低的情况下,均在第24周之间进行。 结论。在第24周通过第24周的AE率为220.8/100 Py(TNFI-Naïve)和251.6/100 PY(TNFI-SPACSECED)在PBO组中的GUS组中为GUS组和196.1/100 PY(TNFI-NAïve)和303.0/100 PY(TNFI-NAïve)和PY(TNFI-nemented)。在所有经过GUS治疗的患者(包括从PBO越过的患者)中,在长期评估期间,在TNFI-NOHEVE(139.7/100 PY)和TNFI经验(174.0/100 PY)患者中,均保持了低AE率。率/100 py的AE,导致治疗中断,严重的AE和其他感兴趣的AE,以及在PBO和GUS治疗的患者之间保持较低的肝转氨酸酶水平和中性粒细胞计数的升高和降低的中性粒细胞计数在第24周之间是一致的,无论与先前的TNFI使用,无论在研究的最终范围内均未使用,无论与先前的TNFI使用不管,无论是在先前的TNFI使用和较低的情况下,均在第24周之间进行。结论。TNFI经验的患者中GUS的安全性与TNFI-NOTHE患者的安全性是一致的,TNFI-NOPH患者的安全性长达2年。[ClinicalTrials.gov:2阶段(NCT02319759),Discover-1(NCT03162796),Discover-2(NCT03158285)和Cosmos(NCT03796858)]