XiaoMi-AI文件搜索系统
World File Search System世界医师会人类基因编辑声明
近来的科学进展使得基因编辑得以实现,可,甚至能够细,人类基因编辑也迅速发展。这些的实验室正在进行基因编辑的基础科学研究。,人类基因编辑也迅速发展。这些,人类基因编辑也迅速发展。这些,(非生殖),(预料不会引发会影响后代或生殖系(生),(预料不会引发会影响后代或生殖系(生 预料不会引发会影响后代或生殖系(生),细胞的遗传变化。细胞的遗传变化。细胞的遗传变化。,细胞的遗传变化。细胞的遗传变化。力,但这项技术引发强烈的安全性、伦理、法律虽然基因编辑对改善人类生活有庞大的潜,但这项技术引发强烈的安全性、伦理、法律 但这项技术引发强烈的安全性、伦理、法律,更加深上述疑虑。,更加深上述疑虑。更加深上述疑虑。基因编辑的安全疑虑包括非故意或未预期的基因编辑的安全疑虑包括非故意或未预期的 現,進而加深社會不平等或可能遭強制使用。 表觀遺傳變化不可預測的效果也令人擔憂, 因為這會如何影響現有健康生態系統,包括與其 他遺傳變異的交互作用,還有社會規範,皆屬未 知。遺傳改變一旦進入人類領域將難以消除,也 不會侷限在單一社群或國家內部。這些影響對往 後諸多世代來說相當不確定,而有害的修飾可能
开发人工智能来评估心肌细胞运动的“质量” 内藤敦彦 [...
1 以羰基应激为重点的精神疾病发病机制阐明 新井诚 95 开发用于评估心肌细胞运动“质量”的人工智能 内藤敦彦
指向有关人类(同源)细胞材料供应的指南
FDA建议公司为人类细胞材料的收集,存储和运输实施标准程序,尤其是如果在多个地点发生收集的情况下,FDA建议公司实施公司来收集,存储和运输人类细胞材料的标准程序,尤其是在多个地点发生的情况下,在多个地点在符合GMP标准的情况下,没有得出结论。
武縄 聡 博士(神経科学) 博甲第 11082 号 令和 6 年 3 月 25 ...
为了澄清控制雄性小鼠社会偏好的神经回路,Takeawa Satoshi使用光遗传学和化学遗传技术来检查雌激素β受体(ERβ)表达细胞的操纵的影响,这表达了内侧杏仁核(MEA)(MEA)对雌性小鼠的偏好。摘要如下: 在第1章中,作者总结了性类固醇激素对雄性小鼠社会偏好的影响,作为基于先前研究的本文的背景。 Here, the authors state that male mice can identify females in estrus that are suitable for sexual behavior based on olfactory information, and generally prefer females (RF) over non-estrus (XF) and other male individuals (IM), but prior studies have shown that when the ERβ gene of MeA is missing, preference between RF and XF, that is, preference based on female estrus, is inhibited, while preference between RF and IM, that is, preference based on gender, is not inhibited.作者指出,先前研究的结果仅指ERβ蛋白的功能,并且尚未阐明基于发情状态的女性偏好的神经回路基础。考虑到这些背景,作者指出,本文的总体目的是了解集中在MEA背面的ERβ阳性神经元如何调节雄性小鼠的两种偏好:基于女性的偏好和基于性别的偏好。在第2章中,作者解释了一般程序,并同时创建了ERβ-ICRE小鼠应变,这对于实现上述目标至关重要,使用CRISPR-CAS9系统。使用该小鼠将使实验能够在社交偏好测试中专门记录和操纵MEA-ERβ细胞。 在第3章中,作者描述了将纤维光度法应用于ERβ-ICRE小鼠的实验(实验1和2)。首先,在实验1中,作者透露,在“女性雌激素”偏好测试中记录MEA-ERβ细胞的神经活性,该测试在搜索RF时强烈激活MEA-ERβ细胞,并指出MEA-ERβ细胞会特别响应RF异常和显示出偏好的伴侣的可能性。接下来,在实验2中,作者指出,MEA-ERβ细胞专门用于RF。
综论报告类囊胚:
差异介质,TDM),nive pscs 透过自我组织的方式形成类囊胚( Yu等人,2021a)。polo polo(polo 团队则利用再程式化纤维母细胞((成纤维细胞))te te te te te te te te pre,pre,进行聚合形成称为iblastoids 的类囊胚( liu et al。 (腔)liu等人,2021; Yu等人,2021a)。人类类囊胚的制作方法经不断改,naive Esc或ipscs(Yanagida等,2021; Kagawa等,2022; Yu等人,2023年)、EPSCS(Fan等,2021; Sozen等,2021),以及8Clcs (Mazid等,2022; Yu等人,2022年),子宫内膜上皮细胞)(Kagawa等,2022)(2022))子宫内膜基质细胞(2023)(2023))(2023))进进
基于新能源发电改进型移相全桥变换器研究
中图分类号 : TM561 Analysis of Improved Phase-shift Full-bridge Converter for New Energy Generation ZENG Zhihui 1, 2 LIU Yunpeng 1, 2 ZHANG Linmei 1, 2 YANG Ming 1, 2
95. 开发人工智能评估心肌细胞运动“品质” 内藤敦彦
运动。Front Cell Dev Biol. 2020 年 9 月 10 日;8:542562。PMID:33015053;doi:10.3389/fcell.2020.542562。
通过癌细胞中双链RNA识别途径的抗肿瘤免疫力...
在癌细胞中,纺锤体形成检查点(SAC)的抑制剂激活了DSRNA识别途径,不仅是先前报道的DSDNA识别途径,而且还通过诱导DSRNA在细胞质量中的积累而诱导DSRNA识别途径,并具有染色与非分开(*3)。我们还揭示了DSRNA识别途径的激活诱导抗肿瘤免疫相关因子的分泌,例如T细胞趋化因子和1型干扰素,这些因子促进了T细胞迁移和激活。接下来,为了阐明与非隔离的染色对,使用免疫沉淀产生的dsRNA特异性识别dsRNA,并通过免疫药物的序列确定了序列的序列,并确定了序列的序列,并确定了序列的差异,并确定了sac抑制剂的浓缩。结果,我们发现DSRNA倾向于由散射的重复序列(*5)产生,这些重复序列(*5)相对接近基因组中的基因区域,并且在非编码区域(*4)周围被ATAC-SEQ检测为开放染色质区域,并且染色质构象可能影响散射重复的转录活性。还知道,当SAC抑制诱导染色体敞开时,形成了包含称为微核的不完整基因组的细胞内细胞器,在纯化了细胞核和微核并分析包含的RNA后,它揭示了许多转录产物。最后,在小鼠模型中,我们使用缺乏MAV中的细胞在囊肿抑制剂后分析了肿瘤的生长,该细胞在DSRNA识别途径中起着核心作用和免疫缺陷小鼠(*6),并发现囊抑制剂通过抗衰测依赖性依赖于DSRNA的活性在DSRNA上发挥治疗作用。 [展开]
新闻稿“利用 CRISPR/Cas9 和纳米胶束进行脑内肿瘤形成......
基因组编辑疗法是一种突破性的治疗方法,只需一次治疗就能提供持久的效果。 利用mRNA可以进行高度安全的基因组编辑治疗。 纳米胶束可用于安全有效地将 RNA 输送到大脑。通过将Cas9-mRNA和引导mRNA整合到同一个纳米胶束中,可以有效地进行大脑中的基因组编辑。 基因组编辑已在多种细胞类型中得到证实,包括神经元、星形胶质细胞和小胶质细胞。 这是世界上第一份确认使用基于 RNA 的 CRISPR/Cas9 传递技术在脑实质细胞中进行基因组编辑的报告。 希望在未来,这将为亨廷顿氏病(舞蹈病)、阿尔茨海默氏病等难治性脑部疾病提供新的治疗选择。
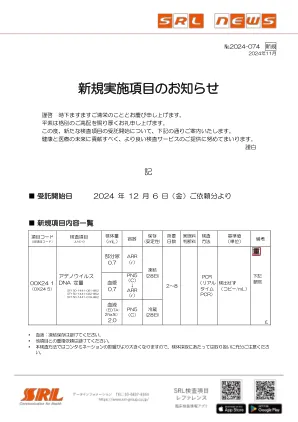
腺病毒 DNA 定量
* 今年提交报告的最后日期为12月24日星期二,今年提交报告的最后日期为12月27日星期五。参考文献:陆鑫等. J Clin Microbiol 51(4):1089~1093,2013. (试验方法参考)日本造血细胞移植协会:造血细胞移植指南-病毒感染的预防和治疗-出血性膀胱炎:2018年。 (临床意义参考)