XiaoMi-AI文件搜索系统
World File Search System靶向TSHR的一种新型的口服小分子拮抗剂可改善Graves疾病的体内模型Jun Zhang,Kiana Alvarez,Ivan G
在这里,我们描述了一种新型,有效和选择性的口服生物可利用的小分子TSHR拮抗剂的概念证明数据,该分子TSHR拮抗剂直接靶向TSHR功能,可用于治疗坟墓疾病的表现,包括潜在的眼科表现。使用原代小鼠甲状腺细胞确定小分子化合物SP-1351的体外药理作用。表明,TSH和患者衍生的自身抗体对原代胆红素的功能基因表达产生刺激作用。通过长期激活自身抗体的施用,建立了甲状腺功能亢进症的体内鼠模型。该模型的表征表明,与甲状腺功能亢进相关的关键基因被上调,循环T3和T4的水平失调,甲状腺本身的总体大小显着增加,反映了坟墓疾病的影响。用小分子负构构调节剂重复治疗10天,降低了甲状腺的总体大小,并改善了与Graves疾病(如卵泡肥大和卵泡胶体还原)相关的组织学参数。在T4诱导的急性小鼠模型中,口服SP-1351的口服给予治疗后的T4水平迅速减弱。
一种新的天然儿茶酚-O-甲基转移酶抑制剂对帕金森氏病体内模型的影响
Valeria parrales -Macias - ICM, Pitié Salpêtrière hospital, Paris, 75013, France Abha Harfouche - University Paris -Saclay, CNRS, Biocis, Orsay, 91400, France Laurent Ferrié - University Paris -Saclay, CNRS, Biocis, Orsay, 91400, France Stéphane Haïk - ICM,Salpêtrière,巴黎,75013,法国帕特里克·米歇尔(Patrick P.rita raison-vozari-icm,PitiéSalpêtrière医院,巴黎,75013,法国Brunofigadère-Paris-Saclay University,CNRS,Biocis,Biocis,Orsay,Orsay,91400,91400 *nicolas.bizat@icm-institte.org alexandre maciuk-University of Paris-Saclay,CNRS,Biocis,Orsay,Orsay,91400,法国 *alexandre.maciuk@universite-parisite-paris--paris-saclay.fr.这些作者为工作做出了同等贡献。
通过体外和体内模型对抗炎活性的评估Akshitha Kalwarala 2,Shriya Kumari.J 2,Shivanandu.K 2,Suresh.k 2,var
收到:28-01-2025 /接受了修订:02-02-2025 /发布:07-02-2025摘要:炎症是免疫系统对有害刺激的复杂生物学反应,例如病原体,受损细胞或刺激性。慢性炎症与各种疾病有关,包括自身免疫性疾病,心血管疾病和癌症。抗炎药旨在调节或抑制炎症,从而提供治疗益处。本文探讨了用于研究抗炎机制的体内和体外模型,并评估潜在抗炎药的功效。体外模型,例如细胞培养物和细胞因子测定,提供了控制特定分子和细胞途径的受控环境。相比之下,包括动物研究在内的体内模型,提供了对系统性反应和药代动力学的见解。对这些模型的全面理解对于开发有效的抗炎疗法至关重要。本评论重点介绍了体内和体外方法的优点,局限性和应用,为临床前研究中选择适当的模型提供了一个框架。关键词:炎症,细胞因子测定,体外和体内模型。
系统内模块(SOM)组件和存储指南
最重要的优势是减少组件和底物的翘曲。通过使用此焊接过程,可以集成低成本的塑料,可以使用组件和层压材料,并随着相关的财务和环境利益而降低能耗。
胃癌:在临床前体内模型中鉴定可抑制药物靶点并介导疗效的 microRNA
摘要。除了化疗外,靶向疗法已被批准用于治疗局部晚期和转移性胃癌。治疗效果显著,但应实现更持久的反应和生存率的提高。因此,确定新的靶点和新的临床治疗方法至关重要。在这篇综述中,我们在文献中搜索了干扰可用药靶点并在临床前体内疗效模型中表现出疗效的下调 microRNA。作为可用药靶点,我们选择了跨膜受体、分泌因子和酶。我们确定了 38 个符合所述标准的 microRNA。共有 13 个 miR 靶向跨膜受体,9 个抑制分泌蛋白,16 个减弱酶。这些 microRNA 是胃癌重建治疗的靶点。对于所有已确定的 microRNA,必须进行进一步的靶点验证实验。胃癌 (GC) 是全球第三大癌症病因,也是第四大常见癌症,全球每年死亡人数为 700 000 人 (1)。从分子角度来看,已鉴定出以下亚型:Epstein–Barr 病毒、微卫星不稳定性、
用于电场治疗伤口的生物电子设备可减轻小鼠体内模型中的炎症
在伤口愈合过程中,电信号在细胞对组织损伤的反应中起着至关重要的作用,外部电场 (EF) 可以加速愈合过程。在这里,我们开发了一种独立的、可穿戴的、可编程的电子设备来管理良好控制的外源性 EF,旨在加速体内小鼠模型中的伤口愈合,以提供临床前证据。我们通过组织学染色评估上皮化率和 M1/M2 巨噬细胞表型的比率来监测愈合过程。经过三天的治疗,M1/M2 巨噬细胞比率下降了 30.6%,与对照组相比,EF 治疗伤口的上皮化趋势呈非统计显著的 24.2% 增加。这些发现表明该装置通过促进修复性巨噬细胞而非炎性巨噬细胞来缩短炎症期,并加速上皮化。我们的可穿戴设备支持将程序化 EF 应用到体内伤口管理的理论基础,并为进一步开发基于调节巨噬细胞和炎症以更好地愈合伤口的技术提供了令人兴奋的基础。
当前对用于乳腺癌研究和相关药物开发的体内模型的观点
摘要简介:动物模型在乳腺癌研究中起着至关重要的作用,尤其是小鼠和大鼠,它们会发展出与人类非常相似的乳腺肿瘤。这些模型允许研究乳腺癌作用背后的机制,以及新的疗效和安全性,并具有更有效和有利的治疗方法。了解每个模型的优势和缺点对于为研究目的选择最合适的模型至关重要。涵盖的区域:本综述提供了可用于乳腺癌研究的动物模型的简洁概述,讨论了每种动物模型的优势和缺点,以搜索这种类型的癌症的新的,更有效的治疗方法。专家意见:啮齿动物模型提供了有关疾病遗传改变,肿瘤微环境的宝贵信息,并允许评估化学治疗剂的功效。但是,体内模型有局限性,其中之一是它们没有完全模仿人类疾病。选择最适合研究目的的模型对于开发新的治疗剂至关重要,这些治疗剂为乳腺癌患者提供更好的护理。
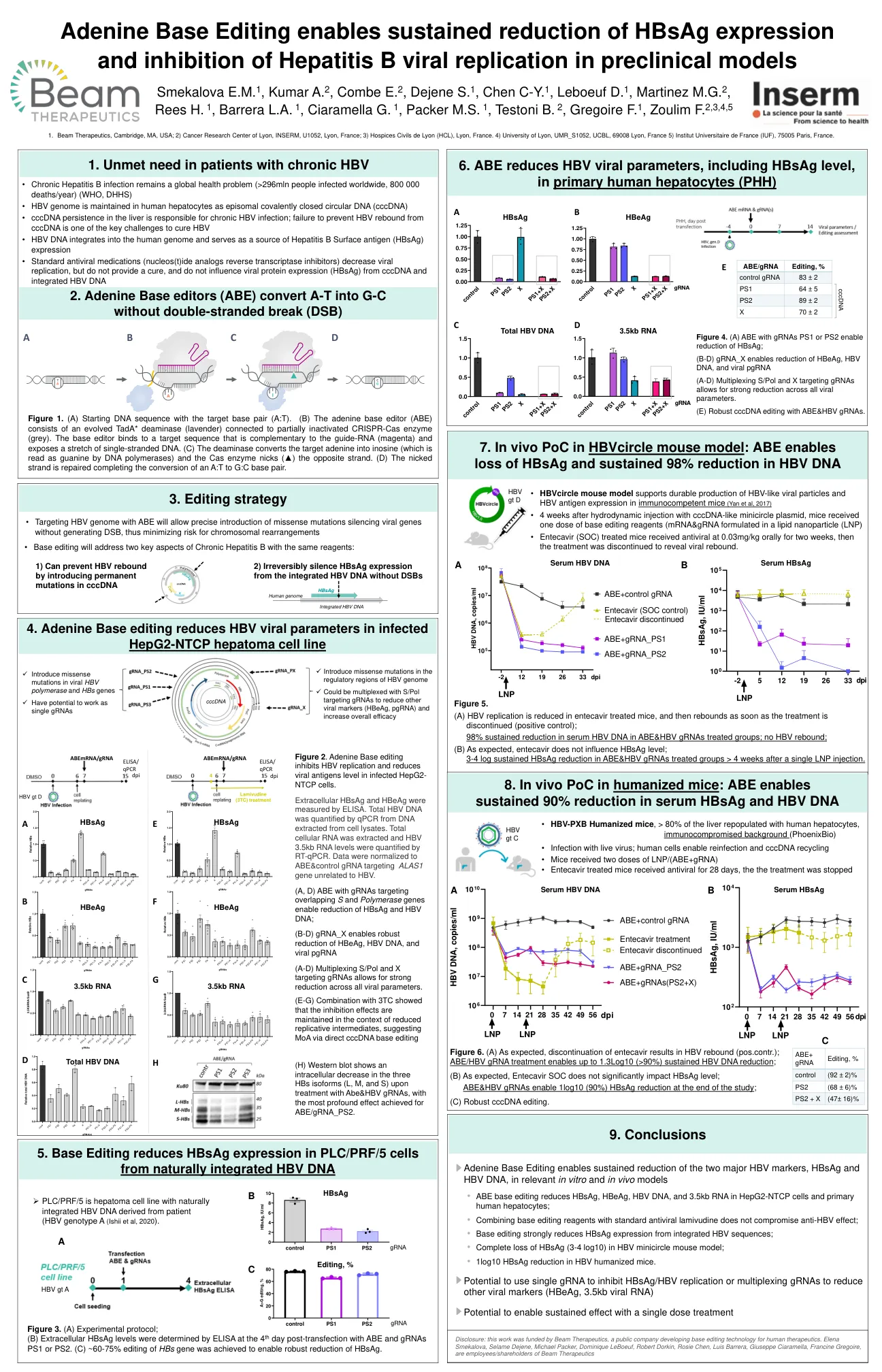
腺嘌呤碱基编辑能够在相关的体外和体内模型中持续降低两种主要的 HBV 标志物 HBsAg 和 HBV DNA
图 1. (A) 起始 DNA 序列,其中包含目标碱基对 (A:T)。(B) 腺嘌呤碱基编辑器 (ABE) 由进化的 TadA* 脱氨酶 (淡紫色) 和部分失活的 CRISPR-Cas 酶 (灰色) 组成。碱基编辑器与与向导 RNA (洋红色) 互补的目标序列结合,并暴露一段单链 DNA。(C) 脱氨酶将目标腺嘌呤转化为肌苷 (DNA 聚合酶将其读取为鸟嘌呤),Cas 酶切口 (▲) 另一条链。(D) 切口链被修复,完成从 A:T 到 G:C 碱基对的转换。
乳腺癌:环状 RNA 在临床前体内模型中介导疗效
摘要。为了确定乳腺癌的新靶点和治疗方式,我们在文献中搜索了在临床前乳腺癌相关体内模型中有效的环状 RNA (circRNA)。通过我们的搜索,我们确定了 26 个上调和 6 个下调的 circRNA,它们在乳腺癌相关的临床前体内模型中起着作用。我们讨论了已确定的 circRNA 的重建和抑制,以及在化学耐药性、增殖抑制和转移背景下确定的靶点的药物性和验证。由细胞因子和高迁移率族蛋白抑制剂、核因子 ĸB 和 Hippo 信号传导驱动的途径成为肿瘤生长和转移的重要驱动因素。三叶因子 1 在雌激素受体阳性乳腺癌转移中的作用也值得进一步研究。此外,粘蛋白 19 已成为乳腺癌治疗的一个未开发的靶点。
三阴性乳腺癌:在体内模型中具有功效的CIRCRNA
摘要。三阴性乳腺癌(TNBC)是乳腺癌的侵略性亚型,治疗方案不足。为了确定新的靶标和治疗方式,我们搜索了文献中的循环RNA(CIRCRNA),这些循环RNA(CIRCRNA)介导了与TNBC相关的体内临床前模型中的功效。除了调节肿瘤抑制途径的5个下调的CIRCRNA外,我们还确定了15个上调的ciRCRNA。下调和上调是指在相应的非转化细胞和组织中的表达。上调的CIRCRNA包含五种跨膜受体和分泌的蛋白质作为靶标,五个转录因子和转录相关靶标,四个相关的细胞周期相关的CIRCRNA和一种涉及紫杉醇抗性。在本评论文章中,我们讨论了治疗干预的相关方面和方式。可以通过在肿瘤细胞中重新表达相应的ciRCRNA或相应靶标的上调来重新组建下调的ciRCRNA。可以通过小型互为RNA(siRNA)或短发夹RNA(shRNA)的方法来抑制上调的CIRCRNA,或使用小分子或与抗体相关的部分抑制相应的靶标。