XiaoMi-AI文件搜索系统
World File Search System2025 年博士研究生
地 址:湖北省武汉市青山区和平大道 947 号 邮政编码: 430081 联系部门:武汉科技大学研究生招生办公室 电 话: 027-68862830 网 址: http://ysxy.wust.edu.cn 单位代码: 10488 邮 箱: wustyjsy@wust.edu.cn
博士论文(摘要)kawara kazuma
转座元素对秀丽隐杆线虫的姐妹种类(可转座元素的影响对C. inopinata的进化,Caenorhabditis elegrans的亲戚)
江柏翰 博士 Po-Han Chiang, Ph.D.
Fellowship of the Higher Education Academy (FHEA) from Advance HE, 2020 International Certificate of Learning & Teaching in Higher Education Fellowship of Einstein Program of Young Scholars Fellowship Program, 2018 Ministry of Science and Technology (MOST), Taiwan (ROC) Outstanding Students Conference Travel Award from Foundation for the Advancement of 2014 Outstanding Scholarship to attend and present at Neuroscience 2014, Annual Meeting of Society for Neuroscience in Washington DC, USA Outstanding来自2011年杰出奖学金基金会的学生会议旅行奖,参加了2011年神经科学,美国华盛顿特区神经科学学会年度会议,研究兴趣
宋超阳博士|助理教授|南方科技大学
硕士研究生(2013-2014)Yin Bangqi新加坡设计与麻省理工学院(2013-2014)Aditya Ranjan新加坡技术与设计与MIT大学(2016-2017)WU TONG MONASH大学(2018-2018-2018-2018-2020)Liu Sheng Sheng Sheng Electronics Designitute(2018-2020-220)加入了Shaoyin Tech。(2020-2023)冯·施豪(Rveng Shihao)加入了Rvbust Tech。(2020年至2023年)郭尤辛加入了香港公共服务部(2021-2024)Jie Yu Master Class of 2024(2021-2024)Jiang Bingfa Master Class of 2024 of 2024(2021-2021-2025) (2022-2025)Xu Ronghan Master Class 2025(Robocon Sustech的团队负责人)(2023-2026)Huang Bangchao Master Class of 2026
博士论文介绍的通知(公开听证会)
在哺乳动物中,胰腺是一种重要的器官,既可以执行消化(外分泌)和血糖调节(内分泌)功能,而在人类中,它也参与了严重的疾病,例如糖尿病。胰腺被认为是脊椎动物的通用器官,但它们的结构和功能因鱼而异。在脊椎动物的进化中,胰腺演变为包括内分泌细胞和外分泌细胞,这在从鱼到两栖动物的过渡中看到了这一变化。这一进化步骤强调了两栖动物在研究胰腺发育中的重要性。在这项研究中,我们使用伊比利亚蜘蛛(Pleurodeles waltl)研究了胰腺的基本结构,发育过程和再生能力,这是一种主要用于尾尾两栖动物的模型动物。 NEWT胰腺由单个哺乳动物样器官组成,包括外分泌和内分泌组织,并且没有在鱼中发现的肝癌。另一方面,已经揭示了胰腺样组织,被认为是尾胆道独有的,与鱼类胰腺类似。在发育过程中,在原始肠道的发育阶段,在两个裤子芽中的每一个中都开发了两个不同类型的胰腺细胞,并且具有复杂功能的胰腺是独立于肠道形成的,当胰腺由胰腺芽融合在一起时,它们与胰腺类似于胰腺中的胰腺类似的过程,如胰腺中的麦芽麦芽剂中的胰腺。接下来,我们通过破坏CRISPR-CAS 9来调查PDX1基因的效果,PDX1基因是脊椎动物胰腺发展的主要因素,发现在NEWT中开发了未开发的胰腺,随后可以生存。此外,对PDX基因的同步分析表明,除了Newts中的PDX1外,PDX2基因仅在某些鱼类中存在于某些鱼类中,也存在于基因组中。最后,除去了NEW的胰腺,并通过观察细胞增殖模式和测量血糖水平来检查胰腺的再生能力。胰腺去除会诱导临时细胞增殖,但并未导致完整的形态学和结构再生。在这项研究中获得的结果提供了对脊椎动物胰腺的进化轨迹的见解,从消化功能所涉及的原始作用中,以发展为能量代谢的复杂调节,尤其是负责血糖调节的独立器官。我的研究表明,纽特胰腺在填补有关脊椎动物胰腺功能进化的重要知识中的空白方面起着重要作用。
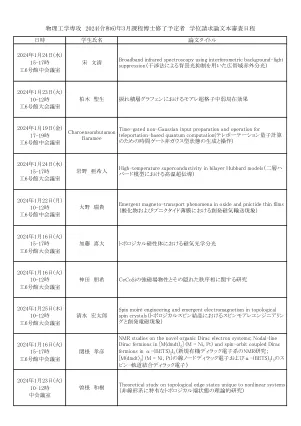
物理工学専攻 2024(令和6)年3月课程博士修了予定者 学位 ...
nmr对[M(DMDT)2](M = Ni,PT)中的Nodal-line Dirac Fermions进行 NMR研究; DMDT)2 I 3)NMR研究; DMDT)2 I 3)
武縄 聡 博士(神経科学) 博甲第 11082 号 令和 6 年 3 月 25 ...
为了澄清控制雄性小鼠社会偏好的神经回路,Takeawa Satoshi使用光遗传学和化学遗传技术来检查雌激素β受体(ERβ)表达细胞的操纵的影响,这表达了内侧杏仁核(MEA)(MEA)对雌性小鼠的偏好。摘要如下: 在第1章中,作者总结了性类固醇激素对雄性小鼠社会偏好的影响,作为基于先前研究的本文的背景。 Here, the authors state that male mice can identify females in estrus that are suitable for sexual behavior based on olfactory information, and generally prefer females (RF) over non-estrus (XF) and other male individuals (IM), but prior studies have shown that when the ERβ gene of MeA is missing, preference between RF and XF, that is, preference based on female estrus, is inhibited, while preference between RF and IM, that is, preference based on gender, is not inhibited.作者指出,先前研究的结果仅指ERβ蛋白的功能,并且尚未阐明基于发情状态的女性偏好的神经回路基础。考虑到这些背景,作者指出,本文的总体目的是了解集中在MEA背面的ERβ阳性神经元如何调节雄性小鼠的两种偏好:基于女性的偏好和基于性别的偏好。在第2章中,作者解释了一般程序,并同时创建了ERβ-ICRE小鼠应变,这对于实现上述目标至关重要,使用CRISPR-CAS9系统。使用该小鼠将使实验能够在社交偏好测试中专门记录和操纵MEA-ERβ细胞。 在第3章中,作者描述了将纤维光度法应用于ERβ-ICRE小鼠的实验(实验1和2)。首先,在实验1中,作者透露,在“女性雌激素”偏好测试中记录MEA-ERβ细胞的神经活性,该测试在搜索RF时强烈激活MEA-ERβ细胞,并指出MEA-ERβ细胞会特别响应RF异常和显示出偏好的伴侣的可能性。接下来,在实验2中,作者指出,MEA-ERβ细胞专门用于RF。
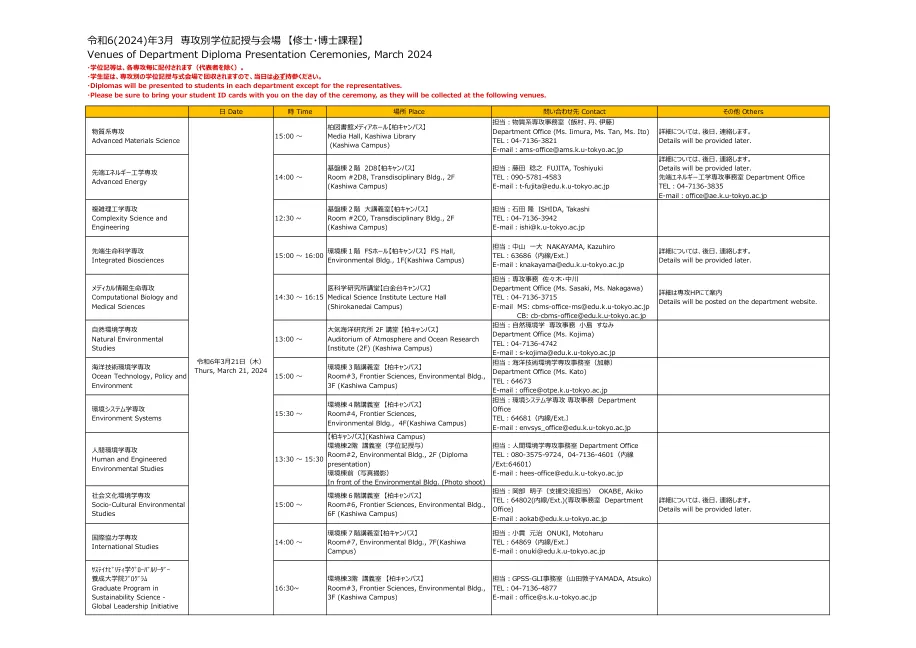
2024年3月:各院系毕业典礼地点【硕士、博士课程】...
・毕业证书等由各学部(代表除外)负责发放。 ・各专业的毕业典礼会场会收集学生证,因此请务必在毕业典礼当天携带。 ・除代表外,各系学生均可获得毕业证书。 ・毕业典礼当天将在以下会场收集学生证,请务必携带。