XiaoMi-AI文件搜索系统
World File Search System5-氟尿嘧啶和喜树碱双药物二肽结合物的自组装
使用基于纳米技术的载体递送抗癌药物组合已成为有效治疗癌症的重要策略。1,2 纳米级尺寸的递送载体还受益于增强渗透性和保留 (EPR) 效应,这使得药物能够选择性地递送到肿瘤细胞中。3 联合疗法可以协同多种药物作用机制,降低全身毒性并抑制耐药性。4-6 协调多种治疗剂细胞摄取的一种策略依赖于封装在单个递送载体中,例如脂质体或聚合物纳米颗粒。7-9 然而,使用具有不同物理化学特性(例如大小、电荷和/或溶解度)的药物来配制这些系统一直很困难,并且通常会产生表现出不可预测的释放速率和不协调的药物生物分布的系统。10 共价
葡萄糖结合麦谷蛋白纳米粒子用于选择性靶向和递送喜树碱到乳腺癌细胞中
摘要 受体介导的药物输送系统是一种很有前途的工具,可用于靶向恶性细胞以抑制/抑制恶性肿瘤而不干扰健康细胞。基于蛋白质的纳米载体系统在输送各种化疗药物(包括治疗性肽和基因)方面具有许多优势。在这项研究中,我们制造了葡萄糖结合的喜树碱负载的谷蛋白纳米粒子 (Glu-CPT-谷蛋白 NPs),以通过 GLUT-1 转运蛋白将喜树碱输送到 MCF-7 细胞。首先,通过还原胺化反应成功合成了谷蛋白结合的谷蛋白聚合物,并通过 FTIR 和 13 C-NMR 证实了这一点。然后,将喜树碱 (CPT) 负载到谷蛋白结合的谷蛋白聚合物中,形成谷蛋白结合的谷蛋白 NPs。研究了纳米粒子的药物释放能力、形态形状、大小、物理性质和 zeta 电位。制备的 Glu-CPT-谷蛋白 NPs 呈球形,本质上为无定形,尺寸范围为 200 nm,zeta 电位为 −30 mV。此外,使用 Glu-CPT-谷蛋白 NPs 进行的 MTT 测定证实了处理 24 小时后对 MCF-7 细胞具有浓度依赖性细胞毒性,IC 50 为 18.23 μg mL −1。体外细胞摄取研究表明 Glu-CPT-谷蛋白 NPs 可增强内吞作用并在 MCF-7 细胞中递送 CPT。用 IC 50 浓度的 NPs 处理后发现典型的凋亡形态变化,即凝聚核和扭曲的膜体。从 NPs 中释放的 CPT 也靶向 MCF-7 细胞的线粒体,显著增加活性氧水平并导致线粒体膜完整性的损伤。这些结果证实,小麦谷蛋白可以积极地充当重要的运载载体并增强这种药物的抗癌潜力。
基于结构的电荷转换药物自组装设计
近年来,各种基于载体的药物输送系统的设计和制造策略已迅速建立并应用于癌症治疗。这些系统对当前的癌症治疗贡献巨大,但需要进一步发展以消除药物负载能力低和严重副作用等障碍。为了实现更好的药物输送,我们提出了一种基于分子结构的易于制造的药物自输送系统的创新策略,该系统可用于共输送姜黄素类化合物和喜树碱的所有含氮衍生物,以更好地靶向癌症治疗并最大限度地减少副作用。形成机制研究表明,喜树碱衍生物和姜黄素类化合物的刚性平面结构以及相关的离去氢使它们能够在适当的条件下组装成纳米颗粒。这些纳米颗粒在不同条件下表现出稳定的粒径(100纳米)和可调的表面电荷,从正常生理条件(pH 7.4)下的约-10 mV增加到酸性肿瘤环境下的+40 mV。此外,小鼠体内实验表明,与伊立替康(喜树碱衍生物)相比,联合给药的伊立替康姜黄素纳米颗粒显著增强了肺和胆囊的靶向性,改善了巨噬细胞清除逃逸,改善了结直肠癌治疗,消除了危及生命的腹泻,为更好的靶向化疗和临床转化带来了希望。最后,基于结构设计的药物自递送系统策略可能会激发更多类似的自递送纳米系统的研究和发现,以用于更广泛的药物应用。
简历:William Zamboi
William C. Zamboni,药学博士,哲学博士 __________________________________________________________________________________ 个人信息 办公室地址: 北卡罗来纳大学教堂山分校 Eshelman 药学院药物治疗和实验治疗学部 1013 遗传医学大楼 120 Mason Farm Road, CB 7361 Chapel Hill, NC 27599-760 办公室电话:919.843.6665 传真:919.966.5863 实验室电话:919.966.9866 手机:412.951.0480 电子邮件:zamboni@unc.edu 教育和培训 哲学博士 2001 - 2005 临床药物科学家项目 匹兹堡大学药学院药学系,宾夕法尼亚州匹兹堡论文题目为“9-硝基喜树碱及其 9-氨基喜树碱代谢物的临床前和临床药理学研究”。研究奖学金 1995 - 1997 药学系 圣犹大儿童研究医院,田纳西州孟菲斯。肿瘤药学住院医师 1994 - 1995 沃伦·G·马格努森临床中心,国立卫生研究院,马里兰州贝塞斯达。药学博士 1992 - 1994 匹兹堡大学药学院,宾夕法尼亚州匹兹堡。药学理学学士学位 1988 - 1992 匹兹堡大学药学院,宾夕法尼亚州匹兹堡。专业经验 学术 北卡罗来纳大学现任学术职位:教授 2022 - 至今
Exatecan 的 TOP1-DNA 捕获以及与 ATR 抑制剂的联合治疗
Exatecan 和 deruxtecan 是抗肿瘤喜树碱衍生物,正在开发中作为肿瘤靶向递送弹头,配方包括肽、脂质体、聚乙二醇 (PEG) 纳米颗粒和抗体-药物偶联物 (ADC)。在这里,我们报告了 exatecan 与临床批准的拓扑异构酶 I (TOP1) 抑制剂的分子药理学以及用于验证生物标志物和 exatecan 与 ATR 抑制剂组合的临床前模型的比较。在 TOP1 裂解复合物界面处对 exatecan 结合进行建模表明,除了喜树碱与 TOP1 残基 R364、D533 和 N722 的三种已知相互作用外,还表明与侧翼 DNA 碱基和 TOP1 残基 N352 存在两种新的分子相互作用。因此,与临床上使用的传统 TOP1 抑制剂相比,依沙替康表现出更强的 TOP1 捕获能力、更高的 DNA 损伤和细胞凋亡。我们证明了 SLFN11 表达和同源重组 (HR) 缺陷 (HRD) 作为依沙替康反应的预测生物标志物的价值。我们还表明,依沙替康与临床 ATR 抑制剂 ceralasertib (AZD6738) 协同杀死癌细胞。为了确定这种组合的转化潜力,我们测试了 CBX-12,这是一种临床开发的 pH 敏感肽-依沙替康缀合物,可选择性靶向癌细胞,目前正在进行临床试验。CBX-12 与 ceralasertib 的组合显着抑制了小鼠异种移植中的肿瘤生长。总的来说,我们的结果表明
以 LGR4/5/6 为靶点的 RSPO4 肽体的喜树碱类似物缀合物在结直肠癌临床前模型中的抗肿瘤活性
(未经同行评审认证)是作者/资助者。保留所有权利。未经许可不得重复使用。此预印本的版权所有者此版本于 2025 年 1 月 16 日发布。;https://doi.org/10.1101/2024.10.08.616548 doi:bioRxiv preprint
以 LGR4/5/6 为靶点的 RSPO4 肽体的喜树碱类似物缀合物在结直肠癌临床前模型中的抗肿瘤活性
(未经同行评审认证)是作者/资助者。保留所有权利。未经许可不得重复使用。此预印本的版权所有者此版本于 2024 年 10 月 11 日发布。;https://doi.org/10.1101/2024.10.08.616548 doi:bioRxiv preprint
重新利用的药物筛选可识别出...
阻断 SARS-CoV-2 刺突蛋白与其受体 ACE2 相互作用的重新利用的药物可以为新型 COVID-19 治疗或预防提供快速途径。在这里,我们从国际监管机构批准的商业药物库中筛选了 2,701 种化合物,以了解它们抑制重组三聚体 SARS-CoV-2 刺突蛋白与重组人 ACE2 结合的能力。我们确定了 56 种以浓度依赖性方式抑制结合的化合物,测量了结合抑制的 IC 50,并通过计算模拟了最佳抑制剂与 Spike-ACE2 结合界面的对接。最佳候选药物是硫链丝菌素、催产素、尼洛替尼和羟基喜树碱,其 IC50 在 4 – 9 μ M 范围内。这些结果强调了一种有效的筛选方法,可以识别能够破坏 Spike-ACE2 相互作用的化合物,以及识别几种潜在的 Spike-ACE2 相互作用抑制剂。
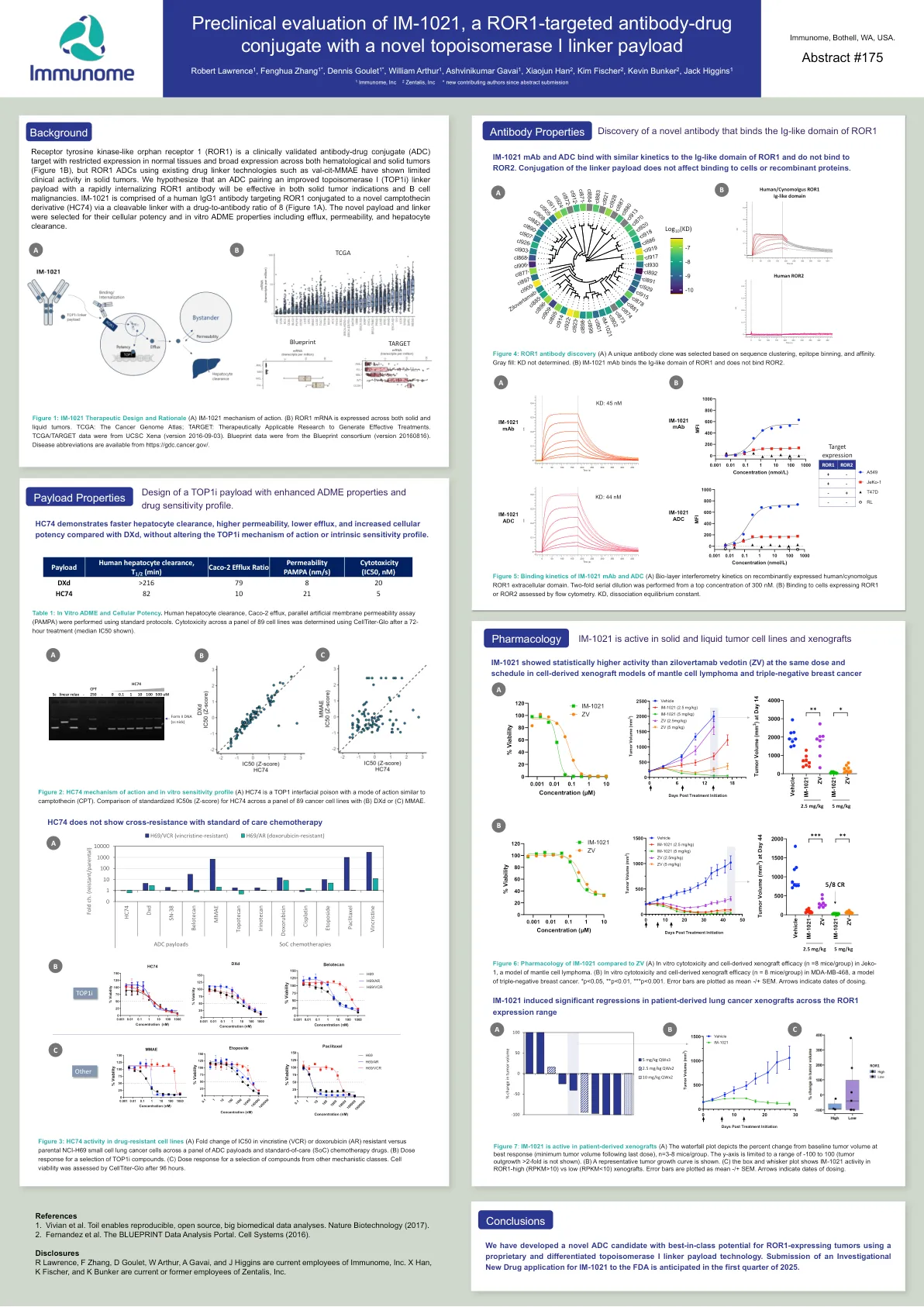
针对 ROR1 的 IM-1021 的临床前评估...
受体酪氨酸激酶样孤儿受体 1 (ROR1) 是一种经过临床验证的抗体-药物偶联物 (ADC) 靶标,在正常组织中表达受限,在血液肿瘤和实体瘤中广泛表达(图 1B),但使用现有药物接头技术(如 val-cit-MMAE)的 ROR1 ADC 在实体瘤中表现出有限的临床活性。我们假设,将改进的拓扑异构酶 I (TOP1i) 接头有效载荷与快速内化的 ROR1 抗体配对的 ADC 将对实体瘤适应症和 B 细胞恶性肿瘤均有效。IM-1021 由靶向 ROR1 的人类 IgG1 抗体组成,通过可裂解接头与新型喜树碱衍生物 (HC74) 结合,药物与抗体的比例为 8(图 1A)。选择新型有效载荷和接头是因为它们的细胞效力和体外 ADME 特性,包括外排、渗透性和肝细胞清除率。
基于 FACS 的全基因组 CRISPR 筛选确定 DNA 损伤信号通路的关键调节因子
DNA 损伤激活信号通路对于协调多个细胞过程至关重要,必须严格调控这些过程才能维持基因组稳定性。为了提供全面、公正的 DDR 信号通路观点,我们在人类细胞系中进行了 30 次基于荧光激活细胞分选的全基因组 CRISPR 筛选,使用识别不同内源性 DNA 损伤信号蛋白的抗体来识别参与 DNA 损伤反应 (DDR) 的关键调节剂。我们发现蛋白酶体介导的加工是细胞触发喜树碱和依托泊苷诱导的 DDR 信号的早期和先决条件事件。此外,我们还确定 PRMT1 和 PRMT5 是调节 ATM 蛋白水平的调节剂。此外,我们发现 GNB1L 是 DDR 信号的关键调节剂,因为它作为辅助伴侣分子,专门调节 PIKK 蛋白。总的来说,这些筛查为进一步研究 DDR 提供了丰富的资源,可能有助于深入了解针对这些 DDR 通路以改善治疗结果的策略。