XiaoMi-AI文件搜索系统
World File Search SystemMSD 白皮书 2024 v2.5.indd
生产力损失涉及所有牲畜品种。在乳制品行业,乳腺炎造成的损失平均导致每公斤牛奶温室气体排放量增加 6%,在受影响最严重的 10% 的奶牛群中,这一数字上升至 11% (Statham, Scott, Statham, et al., 2020)。随着时间的推移,情况已有显著改善 - 目前英国乳腺炎的中位发病率为每年每 100 头奶牛 22 例,而 2016 年为每年每 100 头奶牛 36 例 (Hanks, Taylor and Kossaibati, 2024),但如果尽早诊断和治疗,情况可能会进一步改善。
小型奶牛场气候行动计划
• 91% 的成熟奶牛(哺乳期和干奶期)居住在第 5 区(中央谷地),其次是第 8 区,占 4.3%,其余所有地区占剩余的 4.7%。 • 平均牛群规模从 333 头(第 1 区)到 2,802 头(第 6 区)不等。 • 乳品设施类型在特定区域内和区域之间各不相同。 • 第 5 区超过 74% 的奶牛场使用自由式牛栏饲养哺乳奶牛;这些奶牛场拥有该地区 71.3% 的成熟奶牛。 • 北部各县(例如洪堡和德尔诺特)的奶牛场大多采用牧场系统,与自由式牛栏粪便管理截然不同。一般而言,这些北部地区的粪便管理采用刮取系统,粪便以泥浆、半固体或固体形式储存,或者不从田间收集。 • 6 区(拉洪坦)、7 区(帝国)、8 区(圣安娜)和 9 区(圣地亚哥)的奶牛场主要采用非自由式牛棚,大部分粪便以干燥形式存放,然后刮除并晒干。 • 在中央谷(5 区),约 1.2% 的奶牛场使用部分或完全真空收集方法,1% 使用“排水墙”。1.5
我们开发了一个使用DNA测试检测出异物(动物毛)的套件。
猪,鸡,奶牛,绵羊,马,山羊猫,兔子,狗带小鼠,大鼠和小鼠的大鼠,这些大鼠在卫生管理中尤为重要,可以区分三种栖息地
粮农组织/世卫组织/世界流感大流行专家委员会对近期动物和人类中发生的甲型流感病毒(H5)事件的最新联合公共卫生评估
一致性、呼吸窘迫和流产。8,9,10 研究表明,商业牛奶巴氏灭菌可灭活病毒,使其可供人类安全食用。11,12,13 牛之间的传播途径和方式、病毒脱落的持续时间以及传染期正在研究中,虽然我们的理解有所进步,但这仍然不太清楚。美国各州之间的传播与牛的移动有关,可能通过饲料和粪便处理设备,或在农场工作或参观的人的衣服或鞋子。10 已经发表了关于哺乳奶牛和非哺乳小母牛的实验研究,并为受体分布、病毒复制动力学和感染途径提供了一些见解。研究表明,α2,3唾液酸受体(禽病毒型)在奶牛乳腺组织中含量丰富,这与生牛奶中高病毒载量的观察结果一致,并且在奶牛的呼吸道中也检测到了这种受体。 14,15 然而,一项研究针对奶牛乳腺和呼吸道对甲型流感病毒 (IAV) 的受体结合特异性,结果表明奶牛上呼吸道缺乏 IAV 受体。16 同一项研究表明,奶牛乳腺中大量存在循环 H5 病毒的禽型受体,而缺乏人类型受体。乳腺组织中缺乏人类型受体,这与之前仅依赖植物源凝集素识别受体的研究结果相矛盾。15 对小牛、小母牛和哺乳奶牛进行的实验性接种表明,甲型 H5N1 病毒在乳腺中感染和复制的可能性大于在呼吸道中。在小牛中,鼻腔内接种 A(H5N1) B3.13 基因型病毒导致鼻腔复制不良和病毒脱落,观察到的临床症状较轻,没有报告传播给哨兵小牛。而在哺乳奶牛中,乳房内接种高剂量的 A(H5N1) 病毒(B3.13 或代表性欧洲野生鸟类分离株)导致严重的乳腺感染和坏死性乳腺炎,产奶量急剧下降,没有鼻腔复制或全身感染。17, 18 2024 年 10 月 29 日,美国农业部国家兽医服务实验室确认在俄勒冈州一个后院农场的猪中检测到 A(H5N1) 病毒,10 月 25 日,家禽中也确认存在 A(H5N1) 病毒。该养殖场饲养着多种家禽和牲畜(包括五头猪、绵羊和山羊),它们密切接触,共用水源、住房和设备。尽管猪没有表现出任何临床症状,但它们被安乐死以进行进一步诊断分析。19 五头猪中有两头经聚合酶链反应 (PCR) 检测呈 A(H5N1) 病毒阳性。部分基因组测序表明,A(H5N1) 属于 D1.2 基因型,与同一农场中受感染的家禽相似,而不是 B3.13 基因型。20 俄勒冈州两头猪中检测到 H5N1 病毒并不意外,因为农场中受感染的家禽和猪密切接触,可能导致家禽与猪的传播事件。尽管如此,猪中禽流感的检测值得关注,因为它们可以充当禽流感和人流感病毒基因重组的“混合容器”,可能产生具有大流行潜力的新毒株。A(H5N1) 病毒适应猪的机制以及猪之间有效和持续传播的可能性尚待了解。在猪身上进行的几项 A(H5N1) 进化枝 2.3.4.4b 病毒实验感染研究表明,与禽类来源的 A(H5N1) 病毒株相比,哺乳动物来源的 A(H5N1) 病毒株表现出更高的复制、致病性和传播能力。21,22 尽管如此,禽类来源的
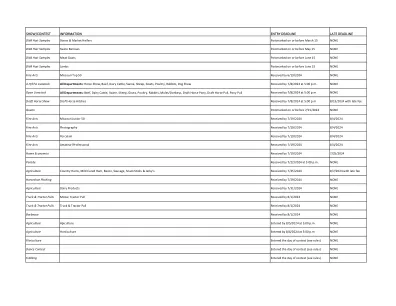
显示/竞赛信息输入截止日期截止日期
开放牲畜所有部门:牛肉,奶牛,猪,绵羊,山羊,家禽,兔子,木瓜/驴,草稿马匹,草稿马拉,小马拉,在7/8/2024,下午5:00收到无
基因编辑 CRISPR/Cas9 系统在 β-乳球蛋白基因敲除的背景下生产低过敏性牛奶的奶牛
BLG 是牛奶中的主要过敏原,约 3% 的婴儿和幼儿对牛奶过敏 [1],而全脂牛奶制成的辅食可能会引发严重疾病 [2]。从牛奶中去除 BLG 可降低其致敏性,并提高其作为幼儿食品的潜力。迄今为止,降低牛奶混合物致敏性的主要方法是深度变性蛋白质。实际上,我们谈论的是肽的混合物,但这可能导致形成新的致敏表位。一种现代替代方法是创建具有 BLG 基因敲除的动物的方法[3,4]。在工业化奶牛品种上进行此类工作尤其重要,因为它可以让您创造特定特征,而不会影响其他具有经济意义的特征和生产力。此前,人们结合了转基因、基因敲除和 SCNT,以及 TALEN 和原核微注射。所有这些都显示出足够的有效性。 Crispr/Cas9 基因编辑技术的快速发展 [5, 6] 使我们能够在用于生产的牛品种中有效引入 BLG 基因突变。在本文中,我们介绍了开发和创建用于引入双链
从母牛到小牛的被动免疫转移
• 益生菌:小牛肠道健康,抑制病原体 • 乳球菌 = 乳酸菌(奶酪、酸奶) • 生物多样性越高,IgG 吸收越好 • 奶牛健康状况(疫苗接种) 特异性 IgG
NIAID研究议程2024 H5N1流感 - 2024年5月
引言于2024年3月,H5N1在美国从美国病假奶牛分离的未经省牛奶的临床样本中检测到高致病性禽流感。4月,据报道,暴露于奶牛的工人中的第一个人类感染。In response to this growing public health concern, the National Institute of Allergy and Infectious Diseases (NIAID), part of the National Institutes of Health (NIH), mobilized its intramural and extramural-supported research infrastructure, including the Vaccine Research Center (VRC), the Bacterial and Viral Bioinformatics Resource Center (BV-BRC), the Centers for Excellence for Influenza Research和响应(CEIRR)网络,以及合作的流感疫苗创新中心(CIVICS)等,以向美国农业部(USDA)和卫生与公共服务部(HHS)提供科学支持,包括其他几个机构。