XiaoMi-AI文件搜索系统
World File Search System4150-胸部转移性曲妥珠单抗Deruxtecan
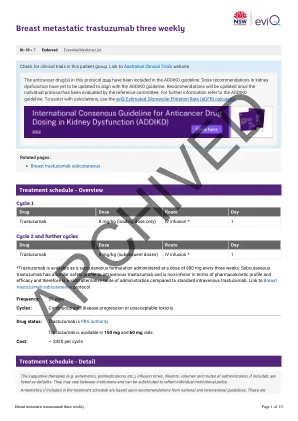
剂量修改的证据是有限的,EVIQ提出的建议仅作为指导。他们通常是保守的,重点是安全。任何剂量修改均应基于临床判断,以及个体患者的状况,包括但不限于治疗意图(治愈性与姑息治疗),抗癌治疗方案(单一对组合疗法与化学疗法与化学疗法与免疫疗法),癌症的生物学,癌症,大小,突变,转移酶的其他副作用,良好的效果,表现良好,效果和其他副作用,表现为其他。修改基于临床试验结果,产品信息,已发表的指南和参考委员会共识。降低剂量适用于每个单独剂量,除非另有说明,否则不适用于治疗周期的总天数或持续时间。非血液学等级基于常见
33-胸转移曲妥珠单抗三周
剂量修改的证据是有限的,EVIQ提出的建议仅作为指导。他们通常是保守的,重点是安全。任何剂量修改均应基于临床判断,以及个体患者的状况,包括但不限于治疗意图(治愈性与姑息治疗),抗癌治疗方案(单一对组合疗法与化学疗法与化学疗法与免疫疗法),癌症的生物学,癌症,大小,突变,转移酶的其他副作用,良好的效果,表现良好,效果和其他副作用,表现为其他。修改基于临床试验结果,产品信息,已发表的指南和参考委员会共识。降低剂量适用于每个单独剂量,除非另有说明,否则不适用于治疗周期的总天数或持续时间。非血液学等级基于不良事件的共同术语标准(CTCAE),除非另有说明。肾脏和肝剂量修饰已在可能的情况下进行标准化。有关更多信息,请参见剂量注意事项和免责声明。
曲妥珠单抗德鲁替康与 HER2 阳性转移性乳腺癌患者医生选择的治疗 (DESTINY-Breast02):一项随机、开放标签、多中心、3 期试验
方法 这项随机、开放标签、多中心、3 期试验在北美、欧洲、亚洲、澳大利亚、巴西、以色列和土耳其的 227 个地点(医院、大学医院、诊所、社区中心和私人肿瘤中心)进行。符合条件的患者年龄为 18 岁或以上,患有不可切除或 HER2 阳性转移性乳腺癌,之前接受过曲妥珠单抗 emtansine 治疗,病情进展,东部肿瘤协作组体能状态为 0 或 1,肾功能和肝功能正常。患者按随机分组随机分配(2:1)接受曲妥珠单抗 deruxtecan(静脉注射,每 3 周一次,剂量为 5.4 mg/kg)或医生选择的治疗。医生选择的治疗方法是卡培他滨 (1250 mg/m²;第 1-14 天,每天口服两次) 加曲妥珠单抗 (第 1 天,静脉注射 8 mg/kg,然后每天一次 6 mg/kg) 或卡培他滨 (1000 mg/m²) 加拉帕替尼 (1250 mg,第 1-21 天,每天口服一次),21 天为一个疗程。主要终点是基于全分析集中的盲法独立中心审查的无进展生存期。本研究已在 ClinicalTrials.gov 注册,编号为 NCT03523585。
Zn-1041的临床前和早期临床数据与曲妥珠单抗Deruxtecan结合使用,用于治疗有或没有CNS转移的乳腺癌
•单独或与Ado-trastuzumab emtansine(T-DM1),曲妥珠单抗Deruxtecan(T-DXD)或Trastuzumab(h)和pertuzumab(p)结合使用Zn-1041的抗肿瘤活性。•Zn-A-1041-101-US(NCT05593094)是一项持续的I期,在美国进行的多中心,开放标签研究。该研究包括Zn-1041单一疗法(IA期)在PT中的剂量升级,其HER2-带有或不带有BM的HER2-阳性实体瘤,以及剂量升级(IB期)和Zn-1041的扩张(1C期)与T-DM1(ARM 1),T-DXD(ARM 2),ARM HERS SERTIST(ARM 2)相结合(ARM 2)带有或没有BM的转移性BC(图1)。•主要目标是安全性,耐受性和建议的II期剂量。次要目标包括实体瘤版本1.1的药代动力学(PK)和初步疗效。
APHINITY 试验 5 中,帕妥珠单抗加曲妥珠单抗双重抗 HER2 阻断治疗早期 HER2 阳性乳腺癌的心脏安全性
1 比利时布鲁塞尔 Jules Bordet 研究所和布鲁塞尔自由大学 (ULB);2 英国金尤西金克雷格前沿科学公司;3 瑞士巴塞尔 F.Hoffmann-La Roche 有限公司;4 巴西圣保罗 AC Camargo 癌症中心临床肿瘤学系;5 热那亚 IRCCS Ospedale Policlinico San Martino UO 肿瘤医学诊所肿瘤内科系;6 意大利热那亚热那亚大学医学院内科和医学科学系 (DiMI);7 布鲁塞尔国际乳腺组织;8 比利时列日 CHU 和列日大学;9 爱尔兰都柏林圣文森特大学医院爱尔兰癌症试验中心;10 美国波士顿 Dana-Farber 癌症研究所; 11 巴西里约热内卢 INCA 国家癌症研究所;12 德国新伊森堡德国乳腺研究组;13 德克萨斯大学休斯顿 MD 安德森癌症中心;14 美国达勒姆杜克大学杜克癌症研究所;15 英国泰恩河畔纽卡斯尔弗里曼医院心脏病学系;16 瑞士伯尔尼大学医院心脏病学系、心脏肿瘤学系
帕妥珠单抗、曲妥珠单抗和芳香化酶抑制剂用于治疗 HER2 阳性和激素受体阳性转移性或局部晚期乳腺癌:PE
摘要 ◥ 目的:在 PERTAIN 的初步分析中(中位随访期 31 个月),在曲妥珠单抗和芳香化酶抑制剂 (AI) 基础上加用帕妥珠单抗,联合/不联合化疗,可显著改善未经治疗的 HER2 阳性和激素受体阳性转移性或局部晚期乳腺癌 (M/LABC) 患者的无进展生存期 (PFS)。在未接受诱导化疗的患者中观察到潜在的增强治疗效果。我们呈现最终分析(中位随访期 > 6 年)。患者和方法:患者 (N = 258) 按 1:1 的比例随机分配接受帕妥珠单抗 (负荷/维持剂量:840/420 mg) 加曲妥珠单抗 (负荷/维持剂量:8/6 mg/kg) 每 3 周和 AI (1 mg 阿那曲唑或 2.5 mg 来曲唑每日;A 组) 或曲妥珠单抗和 AI (B 组)。诱导化疗由研究者决定。主要终点:PFS。关键次要终点:总生存期 (OS) 和安全性。
阿霉素和曲妥珠单抗修饰的金纳米粒子可作为 HER2+ 癌症靶向治疗的潜在多模式药物
摘要:最近,靶向纳米粒子 (NPs) 因其作为药物输送载体的巨大潜力而在癌症治疗中引起了广泛关注。在本文中,我们介绍了一种新型生物共轭物 (DOX-AuNPs-Tmab),它由附着在化疗药物阿霉素 (DOX) 和单克隆抗体曲妥珠单抗 (Tmab) 上的金纳米粒子 (AuNPs,30 nm) 组成,该生物共轭物表现出与 HER2 受体的特异性结合。通过 TEM (透射电子显微镜) 和 DLS (动态光散射) 方法分析了合成的 AuNPs 的大小和形状及其表面改性。对 SKOV-3 细胞系 (HER2+) 进行了生物学研究,结果表明该生物共轭物对受体具有高度的结合特异性和内化能力,而 MDA-MB-231 细胞 (HER2 −) 则没有。细胞毒性实验表明,用 DOX-AuNPs-Tmab 处理的癌细胞代谢活性降低,球体的表面积减少。生物共轭物主要诱导细胞周期 G2/M 期停滞和晚期凋亡。我们的结果表明 DOX-AuNPs-Tmab 在 HER2 阳性肿瘤的靶向治疗方面具有巨大潜力。
曲妥珠单抗(Enhertu)
一项 III 期、多中心、开放标签、随机对照试验 (DESTINY-Breast03;N = 524) 的证据表明,对于之前接受过紫杉烷化疗加曲妥珠单抗治疗的不可切除或转移性 HER2 阳性乳腺癌成年患者,曲妥珠单抗德鲁替康治疗可带来额外的临床益处。DESTINY-Breast03 试验表明,与曲妥珠单抗美坦新相比,曲妥珠单抗德鲁替康治疗可显著改善无进展生存期 (PFS),且具有统计学和临床意义(分层风险比 [HR] = 0.2840;95% 置信区间 [CI],0.2165 至 0.3727;P 值 < 0.0001)。由于 OS 数据不成熟,且在提交的中期分析的预定边界上 OS 没有统计学上显著差异,pERC 无法就曲妥珠单抗 deruxtecan 与曲妥珠单抗 emtansine 对总体生存率 (OS) 的相对影响得出明确结论。
HER2 阳性乳腺癌的曲妥珠单抗耐药性
曲妥珠单抗是人类表皮生长因子受体2(HER2)阳性乳腺癌的标准分子靶向治疗方法,可显著提高该分子亚型乳腺癌患者的生存期。然而,临床上曲妥珠单抗的起效或继发性耐药问题限制了其疗效。因此,探讨曲妥珠单抗耐药机制并制定应对措施具有重要意义。本研究阐述了曲妥珠单抗耐药的潜在分子机制,包括ERBB2突变和核定位、ERBB2的转录和翻译后改变、旁路信号通路的过度激活等,并总结出可能出现的预测曲妥珠单抗耐药的生物标志物和治疗策略,以期为逆转曲妥珠单抗耐药提供研究方向。