XiaoMi-AI文件搜索系统
World File Search System重组青霉素G的定点诱变...
以往用化学方法生产抗生素的方法已经被一种更安全、更环保的方法所取代,即利用微生物作为宿主表达系统生产重组蛋白。为开发PGA的潜力,人们进行了不同阶段的研究,包括重组、基因表达、酶的分离纯化以及利用不同重组宿主进行酶活性测试。有报道称,从大肠杆菌和巨大芽孢杆菌中克隆和通过宿主细胞E. coli BL21(DE3)和DH5α生产重组PGA,并进行了许多优化。PGA的基因表达和分离是令人满意的,但该酶在酶促反应中的活性较低且尚未达到最佳[3]。PGA的低酶活性可能是由酶和底物的结合力较弱引起的。这一假设使我们找到了进一步提高酶活性的方法,即通过提高酶和底物之间的结合强度。
高粱高粱醇溶蛋白基因定点诱变的双元载体构建
高粱 (Sorghum bicolor (L.) Moench) 是世界主要的农业生产谷物作物之一,在干旱地区具有特殊重要性。然而,与其他谷物不同,高粱的营养价值较低,这是由于其种子储存蛋白 (kafirins) 对蛋白酶消化具有抗性等原因造成的。提高高粱营养价值的有效方法之一是获得部分或完全抑制 kafirins 合成或改变 kafirins 氨基酸组成的突变体。利用基因组编辑可以通过在 α- 和 γ-kafirin 基因的核苷酸序列中引入突变来解决此问题。在本研究中,选择了基因组靶基序 (23 bp 序列) 以将突变引入高粱的 α- 和 γ-KAFIRIN 基因。使用在线工具 CRISPROR 和 CHOPCHOP 进行 gRNA 的设计。为 α-KAFIRIN (k1C5) 和 γ-KAFIRIN (gKAF1) 基因选择了两个最合适的靶标。在 BsaI (Eco31I) 位点将相应序列插入通用载体 pSH121。通过 DNA 测序验证克隆过程。使用 SfiI 限制位点将所得构建体亚克隆到兼容的二元载体 B479p7oUZm-LH 中。通过使用 MluI 和 SfiI 切割位点的限制分析确认二元载体的正确组装。通过电穿孔将创建的四个载体 (1C - 4C) 转移到农杆菌菌株 AGL0 中。目前,该载体系列用于使用未成熟胚外植体对高粱进行稳定转化。
利用非整合型Wus2载体增强玉米转化和定点诱变
摘要:高效的遗传转化是快速进行基因功能分析和作物性状改良的先决条件。我们最近证明,使用我们的快速农杆菌介导转化方法,具有 NptII /G418 选择和兼容辅助质粒的新型 T-DNA 双元载体可以有效地转化玉米自交系 B104。在这项工作中,我们实施了非整合型 Wuschel2 (Wus2) T-DNA 载体方法进行农杆菌介导的 B104 转化,并测试了其对难转化自交系 B73 转化和基因编辑的潜力。非整合型 Wus2 (NIW) T-DNA 载体辅助转化方法使用两株农杆菌菌株:一株携带目的基因 (GOI) 构建体,另一株提供 NIW 构建体。为了监测 Wus2 与玉米基因组的共整合,我们将由强组成型启动子驱动的玉米 Wus2 表达盒与新的可见标记 RUBY 相结合,后者产生紫色色素甜菜碱。作为 GOI 构建体,我们使用之前测试过的 CRISPR-Cas9 构建体 pKL2359 进行 Glossy2 基因诱变。当 GOI 和 NIW 构建体都由 LBA4404Thy 菌株递送时,B104 转化频率显著提高了约两倍(10% vs. 18.8%)。重要的是,我们能够使用 NIW 辅助转化方法转化顽固性自交系 B73,并通过省略选择剂 G418 获得了三株无转基因编辑植物。这些结果表明,NIW 辅助转化可以提高玉米 B104 转化频率,并为 CRISPR 技术用于无转基因基因组编辑提供一种新选择。
使用 GeneArt Gibson Assembly HiFi 克隆试剂盒进行定点诱变
仅供研究使用。不可用于诊断程序。© 2024 Thermo Fisher Scientific Inc. 保留所有权利。除非另有说明,所有商标均为 Thermo Fisher Scientific 及其子公司的财产。Amersham 和 Typhoon 是 Cytiva 的商标。SnapGene 是 GSL Biotech LLC 的商标。Gibson Assembly 是 Telesis Bio, Inc. 的商标,经许可和授权使用。APN-9114086 1024
关于通过定点诱变或顺式基因编辑技术产生的生物的规定 AC 3393
如该拟议法律所附的解释性报告所述,该法案旨在更新分别自 2001 年(2001 年 3 月 12 日欧洲议会和理事会第 2001/18/EC 号指令)和 2003 年(2003 年 7 月 8 日第 224 号立法法令)起实施的有关转基因生物 (GMO) 的现行立法。事实上,科学已经开发出克服转基因机制的技术,转基因是通过在生物体的 DNA 中引入不同于生物体本身的 DNA 序列来创造生物体。本提案法所指的新基因组技术(NGT)是通过定点诱变进行的基因组编辑技术,也称为定点或靶向诱变(以下称为基因组编辑)和顺式基因编辑。第一种可以在不引入新遗传物质的情况下精确修改 DNA,欧洲食品安全局 (EFSA) 将其定义为位点特异性核酸酶 1 型 (SDN-1) 和位点特异性核酸酶 2 型 (SDN-2)。基因组编辑使用核酸酶类蛋白质(可切割 DNA 的酶)和短 RNA 序列,可引导核酸酶到达基因组中的特定目标点,可能导致基因失活或将自然界中已经存在的修饰引入其序列中。在这两种情况下,获得的突变相当于可以自发发生的突变。农作物物种内的正常生物多样性就是由于这种突变而产生的。最著名的基因组编辑技术被称为“CRISPR/Cas9”,因为它使用了 Cas9 蛋白,由两位研究人员——法国女性 Emmanuelle Charpentier 和美国人 Jennifer Doudna 于 2012 年开发,这一发现为她们赢得了 2020 年诺贝尔化学奖。CRISPR/Cas9 基因组编辑技术被称为“开启生命科学新时代的基因剪刀”。事实上,通过基因组编辑,可以将在其他品种、野生个体或相关物种中发现的任何有利突变引入栽培品种中,而无需引入新基因,最重要的是避免“传统”的漫长的杂交和回交实践:引入的唯一突变就是期望获得的突变。同源性是指从同一物种或者性相容的相关物种的供体生物中插入遗传物质,例如基因。遗传物质未经修改就被插入。即使同一基因拷贝数的变化,经过轻微的修改,也是每个物种中存在的正常生物多样性的一部分。通过杂交和选择可以实现相同的过程,但时间更长且精度更低。
引文:Saud A Abdulsamad 等人。“基因编辑技术:同源重组、反义 mRNA、RNAi、定点诱变和 CRISPR/
RecA/Rad51家族蛋白诱导的DNA结构的内在动态特性:DNA作为基因组材料可能比RNA更具优势”。美国国家科学院院刊98.15(2001):8425-8432。
环状细菌素 Plantacyclin B21AG 的晶体结构和定点诱变揭示了对抗菌活性很重要的阳离子和芳香族残基
环状细菌素 plantacyclin B21AG 的晶体结构和定点诱变揭示了对抗菌活性很重要的阳离子和芳香族残基 Mian-Chee Gor 1,2,+ , Ben Vezina 1,+ , Róisín M. McMahon 1 , Gordon J. King 3 , Santosh Panjikar 4,5 , Bernd HA Rehm 1,6 , Jennifer L. Martin 1,7 , Andrew T. Smith 1,8, * 1 格里菲斯大学格里菲斯药物发现研究所,Don Young Road,Nathan,昆士兰州,4111 澳大利亚。2 皇家墨尔本理工大学科学学院,Plenty Road,Bundoora,维多利亚州,3083 澳大利亚。3 昆士兰大学理学院,昆士兰州,澳大利亚。4 澳大利亚同步加速器,ANSTO Clayton,维多利亚州,澳大利亚。 5 莫纳什大学分子生物学和生物化学系,墨尔本,维多利亚州,3800 澳大利亚 6 格里菲斯大学细胞工厂和生物聚合物中心,格里菲斯药物发现研究所,内森,昆士兰州,4111 澳大利亚。 7 伍伦贡大学,诺斯菲尔兹大道,伍伦贡,新南威尔士州,2522 澳大利亚。 8 格里菲斯科学学院,格里菲斯大学,黄金海岸,昆士兰州,4222 澳大利亚。
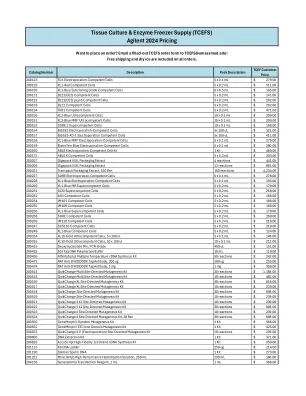
安捷伦 2024 定价
价格 200123 TG1 电穿孔感受态细胞 5 x 0.1 毫升 279.00 美元 200129 XL1-红色感受态细胞 5 x 0.2 毫升 511.00 美元 200130 XL1-蓝色亚克隆级感受态细胞 8 x 0.5 毫升 105.00 美元 200131 BL21(DE3) 感受态细胞 5 x 0.2 毫升 141.00 美元 200132 BL21(DE3) pLysS 感受态细胞 5 x 0.2 毫升 202.00 美元 200133 BL21 感受态细胞 5 x 0.2 毫升 202.00 美元 200134 TKB1 感受态细胞 5 x 0.2 毫升 471.00 美元200150 XL2-Blue 超感受态细胞 10 x 0.1 毫升 209.00 美元 200151 XL2-Blue MRF' 超感受态细胞 10 x 0.1 毫升 299.00 美元 200152 SURE 2 超感受态细胞 10 x 0.1 毫升 188.00 美元 200154 BJ5183 电穿孔感受态细胞 5x 100 微升 321.00 美元 200157 BJ5183-AD-1 电穿孔感受态细胞 5x 100 微升 411.00 美元 200158 XL1-Blue MRF' 电穿孔感受态细胞 5 x 0.1 毫升 279.00 美元 200159 EletroTen-Blue电穿孔感受态细胞 5 x 0.1 毫升 280.00 美元 200160 ABLE 电穿孔感受态细胞试剂盒 1 套 480.00 美元 200172 ABLE K 感受态细胞 5 x 0.2 毫升 303.00 美元 200207 Gigapack III XL 包装提取物 4 次反应 441.00 美元 200209 Gigapack III XL 包装提取物 11 次反应 881.00 美元 200221 Transpack 包装提取物,100 次反应 100 次反应 4,234.00 美元 200227 SURE 电穿孔感受态细胞 5 x 0.1 毫升 278.00 美元 200228 XL1-Blue 电穿孔感受态细胞 5 x 0.1 毫升 195.00 美元200229 XL1-Blue MR 超级感受态细胞 5 x 0.2 毫升 179.00 美元 200231 SCSI 超级感受态细胞 5 x 0.2 毫升 258.00 美元 200232 AG1 感受态细胞 5 x 0.2 毫升 186.00 美元 200234 JM101 感受态细胞 5 x 0.2 毫升 186.00 美元 200235 JM109 感受态细胞 5 x 0.2 毫升 186.00 美元 200236 XL1-Blue 超级感受态细胞 5 x 0.2 毫升 179.00 美元 200238 SURE 感受态细胞 5 x 0.2 毫升 269.00 美元 200239 JM110 感受态细胞5 x 0.2 mL 219.00 $ 200247 SCS110 感受态细胞 5 x 0.2 mL 219.00 $ 200249 XL1-Blue 感受态细胞 5 x 0.2 mL 124.00 $ 200314 XL10-Gold 超感受态细胞,5 x 100 ul 5 x 0.1 mL 148.00 $ 200315 XL10-Gold 超感受态细胞,10 x 100 ul 10 x 0.1 mL 212.00 $ 200415 脱氧核苷酸混合物,PCR 级 400 ul 151.00 $ 200435 10x Taq DNA 聚合酶缓冲液 10 mL 119.00 $ 200436 AffinityScript 多温度 cDNA 合成试剂盒 50 次反应 242.00 美元 200473 RAT 抗 DYKDDDDK 标签抗体,200 ug 200 ug 235.00 美元 200474 RAT 抗 DYKDDDDK 标签抗体,1 mg 1 mg 399.00 美元 200514 QuikChange 多位点定向诱变试剂盒 30 次反应 1,188.00 美元 200515 QuikChange 多位点定向诱变试剂盒 10 次反应 465.00 美元 200516 QuikChange XL 位点定向诱变试剂盒 30 次反应 855.00 美元 200517 QuikChange XL 位点定向诱变试剂盒 10 次反应 239.00 美元200518 QuikChange 定点诱变试剂盒 30 次反应 608.00 美元 200519 QuikChange 定点诱变试剂盒 10 次反应 239.00 美元 200521 QuikChange II XL 定点诱变试剂盒 10 次反应 239.00 美元 200522 QuikChange II XL 定点诱变试剂盒 30 次反应 608.00 美元 200523 QuikChange II 定点诱变试剂盒 10 次反应 239.00 美元 200524 QuikChange II 定点诱变试剂盒,30 次反应 608.00 美元 200550 GeneMorph II 随机诱变试剂盒 1 套 566.00 美元 200552 GeneMorph II EZClone 域诱变试剂盒 1 套 425.00 美元 200555 QuikChange II-E(电穿孔)定点诱变试剂盒 10 次反应 239.00 美元 200600 DNA 提取试剂盒 1 套 371.00 美元 200820 AccuScript 高保真第一链 cDNA 合成试剂盒 1 套 359.00 美元 201115 Kb DNA Ladder 250 ug 214.00 美元 201190 鲑鱼精子 DNA 1 套 273.00 美元 201222 MiracleHyb高性能杂交溶液,250 mL 250 mL 160.00 $ 204130 GeneJammer 转染试剂,1 mL 1 mL 366.00 $
CRISPR-Cas9 载体
CRISPR/Cas9系统已被广泛应用于基因组编辑,包括基因破坏、定点诱变、表观遗传调控等。化脓性链球菌(SpCas9)是目前最常用的Cas9蛋白。通过SpCas9进行基因组编辑需要在靶位点有一个“NGG”原型间隔区相邻基序(PAM)序列,这限制了CRISPR/Cas9系统的编辑范围。为了扩大编辑位点的范围和优化编辑特异性,各种SpCas9突变体已被研究并成功应用于CRISPR系统。