XiaoMi-AI文件搜索系统
World File Search System针对嵌合体的蛋白水解诱导表皮细胞的降解
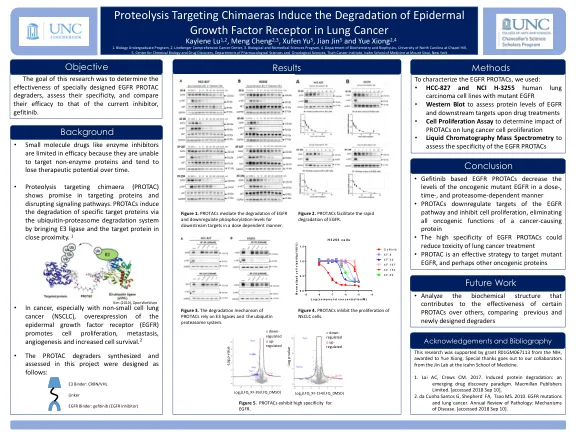
• 基于吉非替尼的 EGFR PROTAC 以剂量、时间和蛋白酶体依赖的方式降低致癌突变 EGFR 的水平 • PROTAC 下调 EGFR 通路的靶点并抑制细胞增殖,消除致癌蛋白的所有致癌功能 • EGFR PROTAC 的高特异性可以降低肺癌治疗的毒性 • PROTAC 是针对突变 EGFR 和其他致癌蛋白的有效策略
基因编辑猪的囊胚互补和种间嵌合体
终末期器官衰竭或急性创伤性损伤与相当高的发病率和死亡率相关。对于许多此类绝症或毁灭性疾病,唯一的治愈疗法是实体器官移植 ( Garry 等人, 2005 年; Virani 等人, 2021 年 )。由于器官捐赠者数量有限,这种治愈性疗法仅适用于需要这些疗法的一小部分患者。例如,据估计,每年有 20 万至 30 万美国成年人可从原位心脏移植中受益,但只有大约 3000 名成年人接受了心脏移植 ( Virani 等人, 2021 年 )。这种差异推动了人们寻求替代疗法。除了心脏病等终末期器官疾病外,还有威胁四肢并最终导致肌肉体积损失的创伤性损伤 ( Corona 等人, 2015 年; Greising 等人, 2016 年 )。目前,治疗肌肉体积损失的治疗方法有限,因此导致大量发病率、截肢、终身残疾和生命损失(Greising 等人,2017 年)。这些慢性疾病和创伤需要新的治疗方法。基因编辑(Doudna 和 Charpentier,2014 年;Jinek 等人,2012 年;Cong 等人,2013 年)和体细胞核移植 (SCNT) 技术等技术进步
错误、嵌合体、偏差和 GC 含量对扩增子测序准确性的影响
摘要 靶向扩增子测序广泛应用于微生物生态学研究。然而,测序伪影和扩增偏差令人担忧。为了确定这些伪影的来源,我们使用由来自 33 种细菌菌株的 16S rRNA 基因组成的模拟群落进行了系统分析。我们的结果表明,虽然测序错误通常只发生在低丰度操作分类单元中,但嵌合序列是伪影的主要来源。单序列和双序列主要是嵌合体。嵌合序列的形成与目标序列的 GC 含量显着相关。低 GC 含量的模拟群落成员表现出较低的嵌合序列形成率。GC 含量对序列恢复也有很大影响。定量能力明显有限,恢复率差异很大,预期和观察到的菌株丰度之间的相关性较弱。GC 含量较高的模拟群落菌株的恢复率高于 GC 含量较低的菌株。由于引物亲和力的差异,还观察到了扩增偏差。两步 PCR 策略将嵌合序列的数量减少了一半。此外,基于模拟群落的比较分析表明,几种广泛使用的序列处理流程/方法,包括DADA2、Deblur、UCLUST、UNOISE和UPARSE,在伪影去除和稀有物种检测方面各有优缺点。这些结果对于提高测序质量和可靠性以及开发新的算法来处理目标扩增子序列具有重要意义。
蛋白水解靶向嵌合体 (PROTAC) 在癌症治疗中的应用:现在和未来
摘要:PROTACs是一种通过泛素-蛋白酶体系统选择性降解靶蛋白的创新技术。与传统蛋白质抑制剂药物相比,PROTACs在肿瘤治疗的有效性、选择性和克服耐药性方面表现出优势,为抗癌药物的研发提供了新的思路。近二十年来,已开发出多种用于诱导肿瘤相关靶点降解的PROTAC分子,并进行了临床试验。本文全面回顾了PROTAC技术的历史里程碑和最新进展,重点介绍了PROTACs的结构、机制及其在靶向肿瘤相关靶点方面的应用,列举了几种基于CRBN、VHL、MDM2或cIAP1 E3连接酶的代表性PROTACs和正在进行抗癌临床试验的PROTACs。此外,还描述了当前研究的局限性以及未来的研究方向,以改进用于癌症治疗的PROTAC设计和开发。
DCAF11 通过亲电蛋白水解靶向嵌合体支持靶向蛋白质降解
摘要:配体诱导的蛋白质降解已成为一种引人注目的方法,通过将蛋白质引导至泛素蛋白酶体机制来促进蛋白质从细胞中的靶向消除。到目前为止,仅发现有限数量的 E3 连接酶支持配体诱导的蛋白质降解,这反映了用于蛋白水解靶向嵌合体 (PROTAC) 设计的 E3 结合化合物的缺乏。在这里,我们描述了一种功能筛选策略,该策略使用候选亲电 PROTAC 的集中库来发现通过共价结合 E3 连接酶来降解人体细胞中蛋白质的双功能化合物。机制研究表明,亲电 PROTAC 通过修饰 DCAF11(一种特征不明显的 E3 连接酶底物接头)中的特定半胱氨酸起作用。我们进一步表明,DCAF11 导向的亲电 PROTAC 可以降解人类前列腺癌细胞中的多种内源性蛋白质,包括 FBKP12 和雄激素受体。我们的研究结果表明 DCAF11 是一种 E3 连接酶,能够通过亲电 PROTAC 支持配体诱导的蛋白质降解。■ 简介
体细胞染色体嵌合体的动态特性、遗传-环境相互作用以及疾病和衰老的治疗机会
背景:体细胞染色体嵌合体是指个体中存在染色体组(例如正常和异常)不同的细胞群。染色体嵌合体与多种疾病状况和衰老有关。研究表明,体细胞基因组变异的染色体异常细胞数量可能不稳定。因此,嵌合率在个体发育过程中会动态变化。此外,疾病严重程度和嵌合率之间似乎存在相关性。高嵌合率通常与严重的疾病表型有关,而低水平嵌合通常见于较轻的疾病表型或可能未受影响的个体。在此,我们假设体细胞染色体嵌合体的动态性质可能是由遗传-环境相互作用引起的,从而为相关疾病和衰老创造了治疗机会。结论:遗传-环境相互作用似乎促成了体细胞嵌合体的动态性质。因此,对细胞群的外部影响可能会改变核型正常和异常细胞的比例,有利于增加没有染色体重排的细胞数量。考虑到体细胞染色体嵌合体在健康和疾病中的作用,我们假设人为改变体细胞嵌合体率可能对患有相关疾病和/或行为或生殖问题的个体有益。此外,此类治疗程序可能有助于抗衰老策略(即通过降低染色体嵌合体水平来实现年轻化),从而延长寿命。最后,该假设似乎适用于任何类型的体细胞嵌合体。
通过选择性蛋白质降解来对抗癌症
摘要:靶向蛋白质降解已成为一种抗癌替代疗法,与传统抑制剂相比具有多种优势。新型降解药物提供了不同的治疗策略:它们可以通过向细胞外蛋白质添加特定部分来穿过磷脂双层膜。另一方面,它们可以通过生成 E3 连接酶的三元复合物结构来有效改善降解过程。在此,我们回顾了基于 TAC 的技术 (TACnologies) 的当前使用趋势,例如蛋白水解靶向嵌合体 (PROTAC)、光化学靶向嵌合体 (PHOTAC)、CLICK 形式的蛋白水解靶向嵌合体 (CLIPTAC)、自噬靶向嵌合体 (AUTAC)、自噬体束缚化合物 (ATTEC)、溶酶体靶向嵌合体 (LYTAC) 和去泛素酶靶向嵌合体 (DUBTAC),在实验开发及其在临床应用方面的进展。
纽约大学医学院高中生物伦理项目器官移植和跨物种嵌合体的伦理问题
本模块探讨了人兽嵌合体及其在器官移植生产中的应用所涉及的伦理问题。目前,美国有大量器官移植积压。器官移植的平均等待时间接近 5 年,每天约有 20 人死于等待移植的名单上。这场危机迫使人们制定新的移植器官获取策略。这些进展之一是利用嵌合体为接受者培育定制器官的前景。嵌合体是由两种遗传上不同的细胞组成的生物体。嵌合可以发生在一个物种内,也可以发生在两个不同物种之间。后一种嵌合体引起了科学家的兴趣,因为它可能是一种生成适合人类移植的器官的方法。提出的策略是从非人类动物胚胎(通常是猪)和人类干细胞中创造嵌合体。最终,在嵌合体成年后,干细胞捐赠者将接受嵌合体移植的新的类人器官。当然,杂交物种和牺牲动物生命进行器官移植会带来一些道德问题,但嵌合体研究已经流行了几十年,并预示着光明的未来。本模块的目标是让学生了解嵌合体研究的主题,特别是它与器官移植的关系,并引发关于这一医学进步的伦理问题的有益辩论。
蛋白水解靶向嵌合体 (PROTAC) 用于靶向蛋白质降解和癌症治疗
蛋白水解靶向嵌合体 (PROTAC) 已被开发为一种有用的靶向蛋白质降解技术。双功能 PROTAC 分子由目标蛋白质 (POI) 的配体(主要是小分子抑制剂)和 E3 泛素连接酶 (E3) 的共价连接配体组成。与 POI 结合后,PROTAC 可以募集 E3 进行 POI 泛素化,然后进行蛋白酶体介导的降解。PROTAC 补充了基于核酸的基因敲除/敲除技术,用于靶向蛋白质减少,并可以模拟药理学蛋白质抑制。迄今为止,已成功开发出靶向约 50 种蛋白质的 PROTAC,其中许多是经过临床验证的药物靶标,其中几种正在进行癌症治疗的临床试验。本文回顾了 PROTAC 介导的癌症(特别是血液系统恶性肿瘤)中关键癌蛋白的降解。总结了这些PROTAC的化学结构、细胞和体内活性、药代动力学和药效学。此外,还讨论了PROTAC技术在癌症治疗中的潜在优势、挑战和前景。
针对癌症的蛋白水解靶向嵌合体 (PROTAC) 的特异性递送及其在癌症免疫治疗中的应用
摘要:蛋白水解靶向嵌合体 (PROTAC) 通过诱导肿瘤过表达致癌蛋白的降解而迅速成为一种潜在的癌症治疗策略。它们可以通过募集 E3 连接酶和利用泛素-蛋白酶体途径特异性地催化目标致癌蛋白的降解。由于其作用方式具有普遍性、不可逆性、可回收性、持久性并且适用于“不可用药”的蛋白质,PROTAC 正在逐渐取代传统小分子抑制剂的作用。此外,它们的应用领域正在扩展到癌症免疫治疗,因为各种类型的致癌蛋白都参与了免疫抑制肿瘤微环境。然而,较差的水溶性和低细胞通透性大大限制了药代动力学 (PK) 特性,这需要使用适当的递送系统进行癌症免疫治疗。本综述首先简要介绍PROTAC的一般特性、发展现状和药代动力学。然后介绍近年来各类PROTAC的被动或主动靶向递送系统的应用研究,并描述它们对PROTAC的药代动力学和肿瘤靶向性的影响。最后,总结了近年来用于癌症免疫治疗的PROTAC药物递送系统。采用合适的PROTAC递送系统有望加速PROTAC的临床转化,并提高其对癌症治疗的有效性。