XiaoMi-AI文件搜索系统
World File Search System1 型强直性肌营养不良症的分子疗法
摘要:强直性肌营养不良症 1 型 (DM1) 是最常见的肌营养不良症,影响多种不同的身体组织,主要影响骨骼肌、心肌和中枢神经系统。DM1 蛋白激酶 (DMPK) 基因中 CTG 重复序列的扩增是该疾病的遗传原因。致病机制主要由 DMPK 基因产生有毒的扩增 CUG 转录本介导。随着新知识、疾病模型和技术工具的出现,在发现改变的途径和治疗干预的潜力方面取得了很大进展,使临床治疗之路更加现实。在这篇综述中,我们描述和讨论了 DM1 的分子治疗策略,这些策略旨在直接针对 CTG 基因组序列、扩增的 CUG 转录本或下游信号分子。
先天性强直性肌营养不良症的超声新发现
摘要 目的 通过超声检查,可以有限地诊断先天性强直性肌营养不良 (CDM),特别是在没有强直性肌营养不良 (DM) 家族史的情况下。我们回顾了 CDM 病例以寻找独特的产前发现。研究设计 一系列单中心病例,其中胎儿患有 CMD,具有特征性的产前发现,并在出生后得到证实。结果 四例产前或产后诊断为 CDM 的胎儿在宫内出现大头畸形。虽然头部测量结果在妊娠中期之前与胎龄相符,但妊娠晚期头围和双顶径均比平均值高出 >2 个标准差 (SD)。腹部和股骨测量结果与妊娠期相符。出生后,所有胎儿的枕额周长均比平均值高出 >2 个 SD,证实了大头畸形的诊断。结论 CDM 应包括在妊娠晚期大头畸形的鉴别诊断中,尤其是在存在其他超声线索且母亲病史和体格检查提示 DM 的情况下。
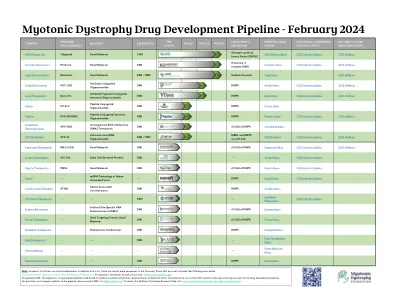
MDF 强直性肌营养不良症药物研发管线
注:以上不包括学术机构。除此列表外,还有几家处于发现阶段但尚未公开其 DM 计划的公司。单击上方的绿色箭头可查看第 1-3 阶段的临床试验信息。有关每个临床试验的地点和详细信息,请访问 www.clinicaltrials.gov 。此管道由 MDF 设计,正在持续开发中,并基于公开信息。特别感谢 Nate Uhl 对 DM 研究前景的全面审视以及对药物开发管道的原创愿景。如有疑问或需要管道更新,请联系 MDF,邮箱地址为 info@myotonic.org 。要查看强直性肌营养不良症研究地图,请访问:www.myotonic.org/myotonic-dystrophy-research-map 。
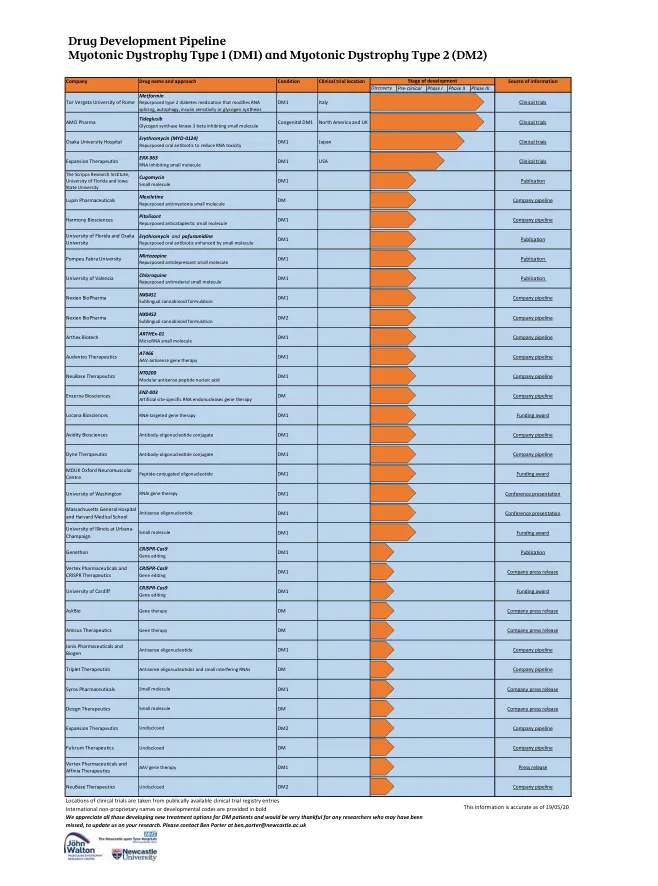
药物开发管道 1 型强直性肌营养不良症 (...
临床试验地点取自公开的临床试验注册条目 国际非专利名称或开发代码以粗体显示 我们感谢所有为糖尿病患者开发新治疗方案的人,并非常感谢任何可能被遗漏的研究人员向我们更新您的研究。请联系 Ben Porter,邮箱地址为 ben.porter@newcastle.ac.uk
2024 年 1 型强直性肌营养不良症的进展
Del-desiran (AOC 1001) – MARINA 和 HARBOR 试验 .............................................. 7 DYNE-101 – ACHIEVE 试验 .............................................................................................. 8 PGN-EDODM1 – FREEDOM-DM1 试验 ............................................................................ 9 ARO-DM1 ...................................................................................................................... 10 VX-670 – Galileo 试验 ...................................................................................................... 10 ATX-01- ArthemiR 试验 ...................................................................................................... 11 AMO-02 – REACH CDM 试验 ............................................................................................. 11 二甲双胍 ............................................................................................................................. 12
探索 1 型强直性肌营养不良症的遗传学及其伦理影响
推荐引用 推荐引用 Smith, Caleb (2024) “探索 1 型肌强直性营养不良的遗传学及其伦理影响”,NEXUS:自由跨学科研究杂志:第 1 卷:第 2 期,第 1 篇文章。DOI:https://doi.org/10.70623/AFQS8761 可从以下网址获取:https://digitalcommons.liberty.edu/nexus/vol1/iss2/1
强直性肌营养不良症 2 型中长度 CNBP 扩增等位基因...
摘要 2 型强直性肌营养不良 (DM2) 是由 CNBP 基因中的 CCTG 重复扩增引起的,该扩增包含 75 至 >11,000 个单位,具有广泛的嵌合性,因此对完全扩增的等位基因进行测序具有挑战性。为了克服这些限制,我们使用无 PCR 的 Cas9 介导纳米孔测序在 9 名 DM2 患者的单核苷酸水平上表征了 CNBP 重复扩增。使用此策略可以精确评估正常和扩增等位基因的长度,与传统方法一致,并揭示了嵌合性的程度。我们还对整个 ~50 kbp 的扩增进行了测序,这在 DM2 或任何其他重复扩增疾病中都是前所未有的。我们的方法精确地计算了重复次数并确定了短中断和不间断等位基因的重复模式。有趣的是,在扩增的等位基因中,只有两个 DM2 样本具有预期的纯 CCTG 重复模式,而其他七个样本在 3 ' 端也呈现出 TCTG 阻断,这在 DM2 患者中以前从未报道过,但在此通过正交方法得到证实。所展示的方法同时确定了重复长度、结构/基序和体细胞嵌合程度,有望改善 DM2 的分子诊断并实现更准确的基因型-表型相关性,从而在临床试验中更好地对 DM2 患者进行分层。
反义寡核苷酸可作为 1 型强直性肌营养不良症中观察到的脑功能障碍的潜在治疗方法
强直性肌营养不良症,或 1 型强直性肌营养不良症 (DM1),是一种多系统性疾病,是成人最常见的肌营养不良症。它不仅影响肌肉,还影响许多器官,包括大脑。脑损伤包括认知缺陷、白天嗜睡以及视觉空间和记忆功能丧失。具有 CUG 重复的突变转录本的表达导致毒性 mRNA 功能的增强。反义寡核苷酸 (ASO) 策略治疗 DM1 脑缺陷的局限性在于 ASO 在全身给药后不会穿过血脑屏障,这表明应考虑其他给药方法。ASO 技术已成为开发多种人类疾病潜在新疗法的有力工具,其潜力已在最近的临床试验中得到证实。使用 IONIS 486178 ASO 靶向来自 DM1 患者人类诱导性多能干细胞的神经细胞中的 DMPK mRNA,可消除 CUG 扩增灶,实现 MBNL1/2 的核重新分布,并纠正异常剪接。在 DMSXL 小鼠脑室内注射 IONIS 486178 ASO 可使不同脑区中突变型 DMPK mRNA 的水平降低高达 70%。它还可逆转新生儿给药后的行为异常。本研究表明,IONIS 486178 ASO 靶向脑中的突变型 DMPK mRNA,并强烈支持基于鞘内注射 ASO 治疗 DM1 患者的可行性。
我们在 FSHD 中处于什么位置以及我们是如何到达这里的?
FDA(2R01FD006071)、CDC(1U01DD001242)、强直性肌营养不良症基金会、肌肉萎缩症协会、钙蛋白酶 3 治疗联盟、Fulcrum、AMO Pharma、Sarepta、Dyne、Vertex、Edgewise、Novartis、ML Bio、辉瑞 • 顾问/顾问委员会:Sarepta、AskBio、Acceleron、