XiaoMi-AI文件搜索系统
World File Search System重塑肺癌的免疫微环境
免疫疗法目前是肺癌最有希望的临床治疗方法,不仅彻底改变了二线治疗,而且现在也批准了第一线治疗。但是,其临床效率不高,并非所有患者都受益。因此,找到扩展抗PD-1/PD-L1的免疫疗法的最佳组合策略现在是一个热门研究主题。常规使用化学治疗药物和靶向药物不可避免地会导致耐药性,有毒副作用和其他问题。然而,最近的研究表明,通过调整药物的剂量并阻止取决于获得的耐药性的突变机制的激活,可以减少毒性副作用,激活免疫细胞并重塑肺癌的免疫微环境。在这里,我们讨论了不同化学治疗药物和靶向药物对免疫微环境的影响。我们探讨了调整给药顺序和时间的影响以及此类反应的机制,并展示合并免疫疗法的有效性和可靠性如何提供改善的治疗结果。
引用Zhang H,Ma L,Peng W,Wang B和Sun Y(2024)肠道微生物群和2型糖尿病的发作之间的关联:两种样品Mendel 心血管疾病的见解 水和碳动力学,森林和草原的生态系统稳定性响应气候变化 社论:核苷,核苷酸和核酸 利用肿瘤微环境进行妇科癌症治疗 自发皮肤中的生物传输循环microRNA ...
2型糖尿病(T2DM)在21世纪(国际糖尿病联合会(IDF),2022年)以惊人的速度增长。T2DM及其并发症在所有地区都带来了沉重的疾病负担(Ali等,2022)。确定与T2DM发展有因果关系的因素可以为预防疾病提供重要的证据基础,并促进新治疗策略的发展。肠道菌群(GM)是一个复杂的生态系统,由大约4×10 13种共生细菌,原生动物,真菌,古细菌和病毒组成(Chen等,2021; Martino等,2022)。gm参与了人体的各种生理活性,例如代谢,炎症过程和免疫反应(Fan and Pedersen,2021; Gill等,2022)。越来越多的证据表明,转基因在T2DM等代谢疾病中起重要作用(Gurung等,2020)。T2DM患者患有代谢疾病和慢性炎症状态,并伴有GM障碍(Yang等,2021)。还发现了GM组成的变化与T2DM的发展以及相关并发症的显着关联(Iatcu等,2021),例如,门类细菌群/企业的不平衡与近距离渗透性相关联,与近距离渗透性相关联,并渗透性渗透性,伴有细胞质,伴有细胞质,并渗透性,并伴有细胞处理效果。随后的DM的炎症反应特征(Iatcu等,2021)。也已经报道了几种细菌,例如发酵乳杆菌,足底和酪蛋白,罗斯伯里亚肠道,akkermansia muciniphila和fragilis菌丝,通过降低流量疗法和维持肠道的速度(IIAT)(降低dm)的风险,通过降低DM发育的风险来发挥保护作用(20)。 尽管如此,有必要区分引起疾病的GM的特征以及疾病或其治疗引起的疾病的特征。 孟德尔随机化(MR)是评估可观察到的可修改暴露或危险因素与临床相关结果之间观察到的关系的因果关系的宝贵工具(Sekula等,2016)。 由于孟德尔的种族隔离和独立的分类法,它可以消除与传统观察性流行病学研究相比,可以消除混杂的偏见,并促进了出现的因果途径的分离表型分组风险也已经报道了几种细菌,例如发酵乳杆菌,足底和酪蛋白,罗斯伯里亚肠道,akkermansia muciniphila和fragilis菌丝,通过降低流量疗法和维持肠道的速度(IIAT)(降低dm)的风险,通过降低DM发育的风险来发挥保护作用(20)。尽管如此,有必要区分引起疾病的GM的特征以及疾病或其治疗引起的疾病的特征。孟德尔随机化(MR)是评估可观察到的可修改暴露或危险因素与临床相关结果之间观察到的关系的因果关系的宝贵工具(Sekula等,2016)。由于孟德尔的种族隔离和独立的分类法,它可以消除与传统观察性流行病学研究相比,可以消除混杂的偏见,并促进了出现的因果途径的分离表型分组风险
先天免疫细胞在结直肠癌肿瘤微环境中的作用以及抗肿瘤治疗研究的进展
大肠癌微环境中的先天免疫细胞主要包括巨噬细胞,中性粒细胞,天然杀伤细胞,树突状细胞和骨髓衍生的抑制细胞。通过分泌多种细胞因子,趋化因子和其他控制这些过程的因素,它们在肿瘤开始和进展中起关键作用。结直肠癌是胃肠道的常见恶性肿瘤,了解先天免疫细胞在CRC微环境中的作用可能有助于改善CRC的治疗方法并增加良好的预后。在这篇综述中,我们全面探讨了先天免疫细胞在结直肠癌(CRC)的启动和进展中的关键作用,以及对当前先天免疫细胞免疫治疗的当前景观的广泛评估,从而为未来的研究策略和临床试验提供了有价值的见解。
通过光动力疗法和纳米颗粒增强癌症免疫疗法:使肿瘤微环境更热使免疫治疗效果更好
癌症免疫疗法在治疗各种恶性肿瘤方面取得了巨大的进步。成功免疫疗法的最大障碍是癌细胞的免疫抑制肿瘤微环境(TME)和低免疫原性。要成功进行免疫疗法,必须将“冷” TME转换为“热”免疫刺激状态,以激活残留的宿主免疫反应。为此,应损坏TME中的免疫抑制平衡,应诱导免疫原性癌细胞死亡以适当刺激杀死肿瘤的免疫细胞。光动力疗法(PDT)是诱导癌细胞免疫原性死亡(ICD)并破坏免疫限制性肿瘤组织的有效方法。PDT会触发链反应,该链反应将使TME“热”并具有ICD诱导的肿瘤抗原呈现给免疫细胞。原则上,PDT和免疫疗法的战略组合将协同作用,以增强许多棘手的肿瘤的治疗结果。采用纳米载体的新技术是开发出来的,以提供光敏剂和免疫治疗剂对TME有效。新一代纳米医学已开发用于PDT免疫疗法,这将加速临床应用。
免疫微环境中的 m6A 修饰
血液系统恶性肿瘤的免疫治疗是一个快速发展的领域,近年来发展势头迅猛,主要包括嵌合抗原受体 T 细胞 (CAR-T) 疗法、免疫检查点抑制剂和其他治疗方式。然而,其临床疗效仍然有限,耐药性带来了重大挑战。因此,需要确定新的免疫治疗靶点和药物。最近,最常见的 RNA 表位修饰 N6-甲基腺苷 (m6A) 已成为各种恶性肿瘤的关键因素。据报道,m6A 突变会影响血液系统恶性肿瘤的免疫微环境,导致免疫逃避并损害血液系统恶性肿瘤中的抗肿瘤免疫反应。本综述全面总结了目前发现的m6A修饰在各种血液系统恶性肿瘤中的作用,特别关注其对免疫微环境的影响。此外,我们还概述了针对血液系统肿瘤治疗的m6A靶向药物的研究进展,以提供新的临床见解。
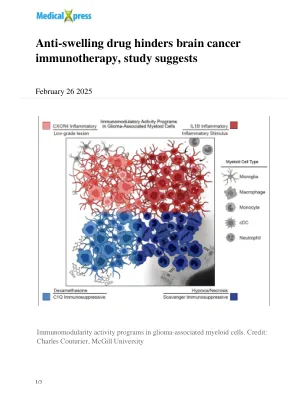
改变肿瘤微环境可能会减少白血病免疫疗法后的复发
值得注意的是,他们在肿瘤中发现了两种类型的免疫抑制性髓样细胞:一种与死组织区域相关,另一种与抗网疗疗法有关。在被给予地塞米松的患者中,这些细胞的免疫抑制作用明显高于未患者,并且随着剂量增加的效果,其影响更强。
COVID疫苗在今年冬天提供了一些保护,估计表明 人类染色体在超速前进化以给我们提供更好的大脑,但是有一个捕获 组合疗法的新目标点挫败了癌症治疗中的多药耐药性 放错位置的神经元可能会破坏大脑的接线并导致发育障碍 改变肿瘤微环境可能会减少白血病免疫疗法后的复发 抗宿舍药物阻碍了脑癌免疫疗法,研究表明 医学中的AI - 对患者自治的威胁? 意外的副作用:间歇性禁食可能会减慢头发再生 为枫糖浆尿液疾病开发的基因疗法表明有望 与小鼠糖尿病保护相关的早期肠道微生物 研究人员发现了与长covid相关的大脑雾的根本原因 基因测试为有针对性的儿童癌症疗法提供了希望 迷幻药在冥想期间提高神秘经历...
今年冬天的疫苗接种水平和严重的共同水平的水平足够低,以至于CDC研究小组的数据中没有足够的患者来可靠地确定受疫苗受保护的儿童,可以防止非老年人的住院,或者阻止任何人患有严重的相互企业并发症或死亡。
超声联合载药微泡改善肿瘤微环境增强免疫疗效的研究进展*
免疫检查点分子阻断剂 ( immune checkpoint blockade , ICB ) 是肿瘤免疫治疗的有效策略之一 , 其中靶向程序 性死亡受体 -1 ( programmed death receptor-1 , PD-1 ) / 程 序性死亡配体 -1 ( programmed death-ligand 1 , PD-L1 ) 的单克隆抗体主要在 TME 中发挥调节免疫细胞功能 的作用。 CD8 + T 细胞是抗肿瘤反应中极具破坏性的 免疫效应细胞群 , 其浸润到 TME 的密度是影响免疫 检查点阻断治疗结果的预测指标 [ 18 ] 。研究表明 , PD- 1/PD-L1 检查点抑制剂与化疗药物联合使用是治疗晚 期非小细胞肺癌的有效方法 , 然而其在肝癌 、 前列腺 癌等实体肿瘤中效果并不理想 [ 19 ] 。为了增强 PD-L1 抗体免疫治疗疗效 , Li 等 [ 20 ] 开发了一种偶联抗 PD- L1 单克隆抗体和负载多西紫杉醇 ( docetaxel , DTX ) 多 功能微泡系统 , 联合超声空化效应增加肿瘤细胞的凋 亡率和 G2-M 阻滞率 , 还可以通过促进 CD8 + T 和 CD4 + T 细胞的增殖 、 降低细胞因子 VEGF 和 TGF-β 的水平来增强抗肿瘤作用。为了提高 PD-L1 抗体在 肝癌中的治疗效果 , Liu 等 [ 21 ] 设计了一种携带 PD-L1 抗体和二氢卟吩 e6 ( chlorin e6 , Ce6 ) 的靶向纳米药物 递送系统 , 该类靶向纳泡可通过 PD-L1 抗体主动靶向 作用 , 促进 Ce6 在肿瘤部位的聚集与释放 , 并通过超 声介导 Ce6 声敏效应促进肿瘤细胞凋亡 、 诱导肿瘤细 胞发生免疫原性死亡 , 同时通过 PD-L1 抗体对 PD- 1/PD-L1 信号通路的阻断促进 CD8 + T 在肿瘤组织中 浸润 , 两者协同发挥抗肿瘤免疫反应。为了增强肿瘤 内部免疫细胞渗透 , Wang 等 [ 22 ] 提出一种将 PD-L1 靶 向的 IL-15 mRNA 纳米疗法和 UTMD 结合的治疗策 略 , 通过声孔效应特异性地将 IL-15mRNA 转染到肿 瘤细胞中 , 激活 IL-15 相关的免疫效应细胞 , 同时阻 断 PD-1/PD-L1 通路 、 诱导免疫原性死亡进而启动强 大的全身免疫反应。 3.3 超声联合载药微泡调节 TME 免疫抑制状态
基质微环体-Iris -Eperto
Strounal“ Lopa-lopes 1,3 1,3 Lida Malagos 1,Anupriya St. Curtain 1,Ann Liu 1,Joseph W.,Elad Horwitz 1,Azfar Neyaz 1,Eric Tai 1,Eric Tai 1,Neelima Magnus 1,Neelima Magnus 1,Kevin D. 1 , Jackson P. Fatherree 1 , Leah J. Damon 1 , Kristina Xega 1 , Melissa Choz 1 , Francis 1 , Adam Langenbucher 1 , Vishal Tapar 1,3 , Robert Morris Daniel A. Haber 1:5,8, Carlos Fernandez-Del-Del 1:2 , Cristina R. Ferrone 1:2 , Martin J. Aryee. 1,3,9,* , & & David Ting 1:4,*
肿瘤微环境的标志及其与新兴免疫疗法方式的相互作用
1 Guy's Cancer Center,Guy's and St Thomas'NHS基金会信托基金会,英国伦敦SE1 9RT; Christian.linares@nhs.net(C.A.L。 ); Sola.adeleke@nhs.net(S.A.)2 Kent肿瘤学中心,Maidstone和Tunbridge Wells NHS NHS Trust,Hermitage Lane,Maidstone,Meadstone,Kent ME16 ME16 9QQ,英国; anjana.varghese@nhs.net 3医学肿瘤学部,梅德韦NHS基金会信托基金会,吉林汉姆ME7 ME7 5NY,英国; aruni.ghose@nhs.net(A.G.); elisabet.sanchez@nhs.net(E.S. ); matin.sheriff@nhs.net(M.S.) 4 Barts Cancer Centre, Barts Health NHS Trust, London EC1A 7BE, UK 5 Mount Vernon Cancer Centre, East and North Hertfordshire NHS Trust, Northwood HA6 2RN, UK 6 Immuno-Oncology Clinical Network, UK 7 Centre for Tumour Biology, Barts Cancer Institute, Cancer Research UK Barts Centre, Queen Mary University of London, London EC1M 6BQ, UK; s.shinde@smd22.qmul.ac.uk 8生命科学与医学学院,癌症与药学学院,伦敦国王学院,伦敦国王学院,伦敦WC2R 2LS,英国9号,99 cyrus.chargari@aphp.fr 10医学肿瘤学,法国维勒维夫94805的医学肿瘤学系; elie.rassy@hotmail.com 11 Kent and Medway医学院,肯特大学,坎特伯雷CT2 7LX,UK 12 AELIA组织,第9 km Thessaloniki -Thermi,57001 Thessaloniki,Greece,Greece *通信 *通信:stergiosssiosboussios@gmail.com或stergios.boil.com或stergios.bous.bous.bous@s.net或stergios.boussios@kcl.ac.uk或s.boussios@kent.ac.uk†这些作者同样为这项工作做出了贡献。1 Guy's Cancer Center,Guy's and St Thomas'NHS基金会信托基金会,英国伦敦SE1 9RT; Christian.linares@nhs.net(C.A.L。); Sola.adeleke@nhs.net(S.A.)2 Kent肿瘤学中心,Maidstone和Tunbridge Wells NHS NHS Trust,Hermitage Lane,Maidstone,Meadstone,Kent ME16 ME16 9QQ,英国; anjana.varghese@nhs.net 3医学肿瘤学部,梅德韦NHS基金会信托基金会,吉林汉姆ME7 ME7 5NY,英国; aruni.ghose@nhs.net(A.G.); elisabet.sanchez@nhs.net(E.S.); matin.sheriff@nhs.net(M.S.)4 Barts Cancer Centre, Barts Health NHS Trust, London EC1A 7BE, UK 5 Mount Vernon Cancer Centre, East and North Hertfordshire NHS Trust, Northwood HA6 2RN, UK 6 Immuno-Oncology Clinical Network, UK 7 Centre for Tumour Biology, Barts Cancer Institute, Cancer Research UK Barts Centre, Queen Mary University of London, London EC1M 6BQ, UK; s.shinde@smd22.qmul.ac.uk 8生命科学与医学学院,癌症与药学学院,伦敦国王学院,伦敦国王学院,伦敦WC2R 2LS,英国9号,99 cyrus.chargari@aphp.fr 10医学肿瘤学,法国维勒维夫94805的医学肿瘤学系; elie.rassy@hotmail.com 11 Kent and Medway医学院,肯特大学,坎特伯雷CT2 7LX,UK 12 AELIA组织,第9 km Thessaloniki -Thermi,57001 Thessaloniki,Greece,Greece *通信 *通信:stergiosssiosboussios@gmail.com或stergios.boil.com或stergios.bous.bous.bous@s.net或stergios.boussios@kcl.ac.uk或s.boussios@kent.ac.uk†这些作者同样为这项工作做出了贡献。