XiaoMi-AI文件搜索系统
World File Search System植根于科学,受患者启发
该技术以天然抗体生物学为基础,旨在诱导抗体六聚体(六个簇)在与细胞表面的靶标结合后形成。据信这可以增强抗体的自然杀伤能力,同时保留其常规结构和特异性。
行业研究 - 弹药
弹药使美国的武器平台能够以远超对手准确回击致命火力能力的射程获得首发杀伤能力,从而实现主导机动。制导、传感器、瞄准和引信系统的技术飞跃,加上新一代隐形能力,使精确打击的有效性和准确性在十年前是不可想象的。如今的弹药不仅可以瞄准城市中的特定建筑物,而且可以自主操作,沿着预先设定的路线飞向建筑物,引信会在特定楼层引爆弹头。同样,当前和正在开发的接口技术可确保多个系统之间的同步,从而为整个部队提供全方位保护。最后,能量学、运动学和小型化技术的进步为更强大但后勤要求更低的火力奠定了基础,以支持 JV2010 的重点后勤愿景。更小的包装可以提高精确度和杀伤力,这意味着战区内物流占用的空间更小,运输要求更少。
在扩展的Ex Vivo CD8+ T细胞扩展过程中的细胞状态和转录因子调制
收养细胞疗法正成为肿瘤免疫疗法的基石。它依赖于相对长的(> 2周)以肿瘤浸润细胞形式的T细胞的离体扩张,或者通过异源信号蛋白(例如嵌合抗原受体)的表达而修饰的大量细胞。然而,对于在系统水平下T细胞的发育轨迹的了解相对较少,或者是否可以操纵控制这些轨迹的途径以获得临床优势。使用T细胞的大量RNA-seq分析在17天的时间内扩展并搁置,我们产生了一种资源,揭示了基因表达如何随着细胞在激活和体外扩张过程中通过不同细胞状态的过渡而变化。通过将此资源与已发表的单细胞RNA-seq数据整合在一起,我们确定了AP1转录因子(TF)家族FOSL1的成员,该成员fosl1,将CD8 + T细胞用于效应子/杀伤表型。值得注意的是,T细胞扩张期间的FOSL1过表达产生了“超级参与者”的T细胞,这些T细胞由它们的基因表达特征和增强的癌症杀伤能力证明。这为TF在体内扩张期间通过TF修饰的理性工程建立了原理证明,从而提供了改善养养T细胞疗法的途径。
开发抗生长抑素受体 CAR-T 细胞用于治疗神经内分泌肿瘤
摘要 背景 神经内分泌肿瘤 (NET) 过度表达生长抑素受体 (SSTR)。方法 我们开发了一种第二代基于配体的抗 SSTR 嵌合抗原受体 (CAR),其细胞外部分掺入了生长抑素类似物奥曲肽。结果 抗 SSTR CAR T 细胞在体外对 SSTR+NET 细胞系表现出抗肿瘤活性。杀伤活性具有高度特异性,这通过 CAR T 细胞对通过 CRISPR/Cas9 工程改造以表达 SSTR2/5 突变变体的 NET 细胞缺乏反应性来证明。当在 NSG 小鼠中过继转移时,抗 SSTR CAR T 细胞诱导了对人 NET 异种移植瘤的显著抗肿瘤活性。尽管抗 SSTR CAR T 细胞可以识别小鼠 SSTR,这通过它们对小鼠 NET 细胞的杀伤能力可以看出,但在小鼠中未观察到对表达 SSTR 的器官(例如大脑或胰腺)的明显有害影响。结论总而言之,我们的研究结果确立了抗 SSTR CAR T 细胞是 NET 患者早期临床研究的潜在候选者。更广泛地说,已知肽药物可以指导 CAR T 细胞靶向的证明可能会简化多种肽基序的潜在效用,并为多种癌症的治疗应用提供蓝图。
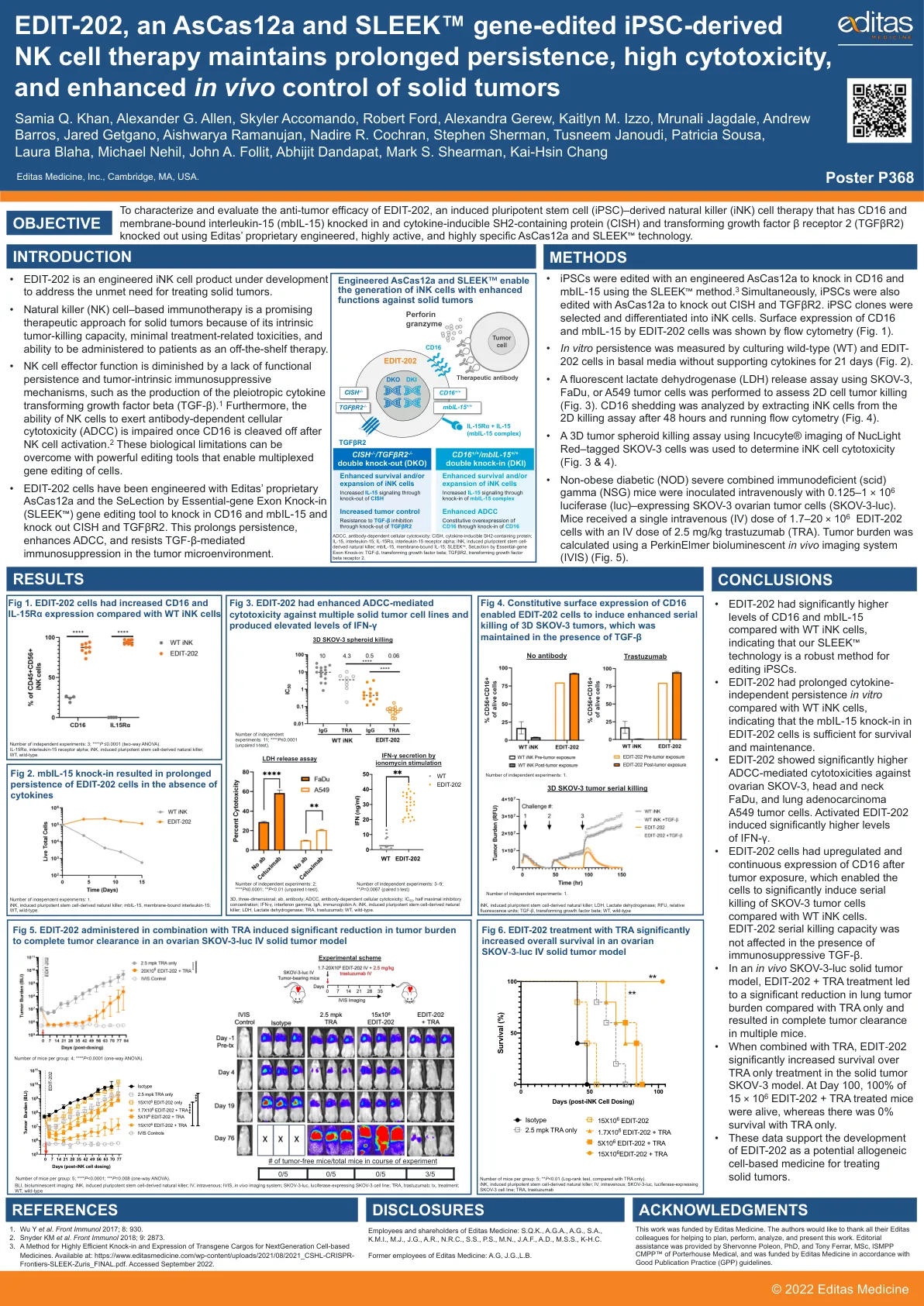
EDIT-202,一种 AsCas12a 和 SLEEK™ 基因编辑的 iPSC-...
• 与 WT iNK 细胞相比,EDIT-202 的 CD16 和 mbIL-15 水平明显更高,表明我们的 SLEEK ™ 技术是一种强大的编辑 iPSC 方法。 • 与 WT iNK 细胞相比,EDIT-202 在体外具有更长时间的细胞因子非依赖性持久性,表明 EDIT-202 细胞中的 mbIL-15 敲入足以维持生存和维持。 • EDIT-202 对卵巢 SKOV-3、头颈部 FaDu 和肺腺癌 A549 肿瘤细胞表现出明显更高的 ADCC 介导细胞毒性。活化的 EDIT-202 诱导的 IFN-γ 水平明显更高。 • 与 WT iNK 细胞相比,EDIT-202 细胞在暴露于肿瘤后上调并持续表达 CD16,这使这些细胞能够显着诱导对 SKOV-3 肿瘤细胞的连续杀伤。 EDIT-202 的连续杀伤能力在存在免疫抑制 TGF-β 的情况下不受影响。• 在体内 SKOV-3-luc 实体瘤模型中,与仅使用 TRA 相比,EDIT-202 + TRA 治疗可显著降低肺肿瘤负担,并导致多只小鼠的肿瘤完全清除。• 与 TRA 结合使用时,EDIT-202 在实体瘤 SKOV-3 模型中比仅使用 TRA 治疗显著提高了存活率。在第 100 天,15 × 10 6 只接受 EDIT-202 + TRA 治疗的小鼠中 100% 存活,而仅使用 TRA 治疗的小鼠存活率为 0%。• 这些数据支持将 EDIT-202 开发为一种用于治疗实体瘤的潜在同种异体细胞药物。
双 pH 响应和肿瘤靶向纳米粒子 - ...
目的:为突破各级生物屏障,提高siRNA的递送效率,通过组氨酸、胆固醇修饰的羧甲基壳聚糖与抗EGFR抗体(CHCE)自组装,制备了一种多功能siRNA递送系统(CHCE/siRNA纳米粒)。方法:通过动态光散射和扫描电镜检测CHCE/siRNA NPs的形貌;体外通过流式细胞术和共聚焦激光扫描显微镜评估其肿瘤靶向性、细胞摄取和内体逃逸能力,证实了CHCE/siRNA NPs的基因沉默和细胞杀伤能力;体内通过IVIS成像系统检测CHCE/siRNA NPs的生物分布,并证实了NPs在裸鼠肿瘤模型中的治疗效果。结果:CHCE/siRNA NPs呈纳米球形,粒径分布窄。体外实验中,CHCE/siRNA NPs 兼具肿瘤靶向性和 pH 响应性的双重功能,能够促进细胞结合、细胞摄取和内体逃逸,可有效沉默血管内皮生长因子 A (VEGFA),引起细胞凋亡并抑制增殖。体内实验中,CHCE/siRNA NPs 可靶向肿瘤部位,敲低 VEGFA,达到更好的抗肿瘤效果。结论:成功制备了一种兼具肿瘤靶向性和 pH 响应性的新型 siRNA 递送系统,该系统可突破生物学屏障,深入肿瘤,达到更好的肿瘤治疗效果,为 siRNA 提供了一种新的理想递送平台。关键词:多功能羧甲基壳聚糖,靶向递送,内体逃逸,基因沉默,抗肿瘤治疗
赛诺菲和奥兰诺联手开发下一代放射性配体药物 巴黎,2024 年 10 月 17 日。赛诺菲和奥兰诺旗下的子公司 Orano Med
赛诺菲和奥拉诺联手开发下一代放射性配体药物 巴黎,2024 年 10 月 17 日。赛诺菲与奥拉诺集团子公司、肿瘤靶向阿尔法疗法开发领域的先驱奥拉诺医疗公司达成协议,结合双方在对抗罕见癌症方面的专业知识,进一步加快开发下一代放射性配体药物。基于奥拉诺医疗的专业知识和放射性配体产品线,赛诺菲和奥拉诺将投资一家以奥拉诺医疗品牌运营的新实体,专注于基于铅-212(212Pb)阿尔法发射同位素的下一代放射性配体疗法 (RLT) 的发现、设计和临床开发。该协议是在赛诺菲宣布与奥拉诺医疗和 RadioMedix 达成独家许可协议之后达成的,以推进罕见癌症的放射性配体疗法 (RLT),重点关注一个后期项目 AlphaMedix™。靶向阿尔法疗法依赖于一个简单的概念:将生物载体靶向癌细胞的能力与发射阿尔法的放射性同位素的短程高能细胞杀伤能力相结合。载体将放射性同位素引导至表达特定标记的目标癌细胞,即使癌细胞已扩散至全身。这种独特的作用机制旨在破坏或摧毁目标癌细胞,同时限制对附近健康细胞的影响。这种新颖的精准医疗方法旨在改变某些罕见癌症的治疗标准,以延长患者的生命并改善他们的生活质量。
背景 肿瘤相关抗原(TAA)是癌症免疫治疗中的关键药物靶点,因为它们在肿瘤细胞上表达较高,而在健康细胞上表达较少。靶向 TAA 的抗体-药物偶联物(ADC)已证明其在临床应用中的潜力,但仍然面临着脱靶毒性和抗肿瘤疗效不理想的挑战。双特异性 ADC(bsADC)和纳米抗体-药物偶联物具有增强的肿瘤特异性、更广泛的杀伤能力和更好的组织穿透性,有可能克服肿瘤异质性。方法 利用专有的无限大小精准染色体工程(SUPCE)技术,我们开发了完全人源抗体发现 RenMice ® 平台(RenMab TM 、RenLite ® 和 RenNano ® )。RenMice ® 经过进一步工程改造,具有特定的药物靶标基因敲除(KO),以产生具有增加的序列和表位多样性的抗体。从 RenMice 或 RenMice KO 平台发现了靶向 TAA 的全人源单克隆抗体 (mAb)、共同轻链抗体和重链抗体 (HCAb),并筛选了其内化活性。我们还开发了一种新型专有接头/有效载荷系统 BLD1102,该系统由高效 DNA 拓扑异构酶 I 抑制剂 (TOP1i) 有效载荷 BCPT02 和亲水性蛋白酶可裂解接头组成。使用我们的 TAA 库和接头/有效载荷系统生成了新型 ADC 和 bsADC,包括抗 CH3 ADC (BCG014) 和抗 PTK7xTROP2 bsADC (BCG033)。它们的内化和体内抗肿瘤活性
环黄芪醇靶向蛋白酶B通过抑制MHC-I降解增强CD8T细胞的抗肿瘤免疫力
摘要 背景 PD-1/PD-L1通路导致肿瘤抗原的丢失和CD8+T细胞的耗竭是肿瘤免疫逃逸的重要因素,近年来,中医药在肿瘤治疗中的研究日益增多,环黄芪醇(CAG)是黄芪中的有效活性分子,具有抗病毒、抗衰老、抗炎等作用,但其抗肿瘤作用及机制尚不明确。方法 在MC38和CT26小鼠移植瘤模型中探究CAG的抗肿瘤作用,通过单细胞多组学测序进一步分析CAG的抗肿瘤作用,利用靶标反应可及性分析技术寻找CAG的靶蛋白,随后利用共聚焦显微镜、免疫共沉淀和突变质粒转染等技术探讨CAG的抗肿瘤机制。最后,研究了CAG与PD-1抗体在小鼠或类器官中的联合抗肿瘤作用。结果我们发现CAG能有效抑制体内肿瘤的生长,我们的单细胞多组学图谱显示CAG促进肿瘤细胞表面抗原的呈递,并以增强CD8+T细胞的杀伤功能为特征。在机制上,CAG与其靶蛋白组织蛋白酶B结合,进而抑制主要组织相容性复合体I(MHC-I)的溶酶体降解并促进MHC-I聚集到细胞膜上,增强肿瘤抗原的呈递。同时,CAG与PD-1抗体的联合使用有效增强了异种移植小鼠和结直肠癌类器官中CD8+T细胞的肿瘤杀伤能力。结论我们的数据首次报道了组织蛋白酶B下调赋予抗肿瘤免疫力,阐明了天然产物CAG的抗肿瘤机制。
与 CAF 抑制剂的协同治疗组合可通过减少 CAF 释放的 IL-6 增强 CAR-NK 介导的细胞毒性
摘要 背景 肿瘤微环境 (TME) 中的癌相关成纤维细胞 (CAF) 导致自然杀伤 (NK) 细胞功能受损,而自然杀伤 (NK) 细胞已成为一种有前途的治疗方式。TME 内的 CAF 和 NK 细胞之间的相互作用对免疫反应具有主要的抑制作用,表明 CAF 靶向疗法是有效 NK 介导的癌症杀伤的潜在靶点。 方法 为了克服 CAF 诱导的 NK 功能障碍,我们选择了抗纤维化药物尼达尼布进行协同治疗。为了评估协同治疗效果,我们建立了体外 3D Capan2/患者来源的 CAF 球体模型或体内混合 Capan2/CAF 肿瘤异种移植模型。通过体外实验揭示了 NK 介导的与尼达尼布协同治疗联合的分子机制。随后评估了体内治疗组合功效。此外,通过免疫组织化学方法测量患者来源的肿瘤切片中靶蛋白的表达评分。结果尼达尼布阻断了血小板衍生的生长因子受体 β (PDGFR β ) 信号通路并减少了 CAF 的激活和生长,从而显著降低了 CAF 分泌的 IL-6。此外,在 CAF/肿瘤球体或异种移植模型中,尼达尼布的联合给药提高了间皮素 (MSLN) 靶向嵌合抗原受体-NK 介导的肿瘤杀伤能力。协同组合导致体内强烈的 NK 浸润。尼达尼布单独使用没有效果,而阻断 IL-6 反式信号传导可改善 NK 细胞的功能。MSLN 表达和 PDGFR β + -CAF 群体面积(潜在的预后/治疗标志物)的组合与较差的临床结果相关。结论我们针对含有 PDGFR β + -CAF 的胰腺癌的策略可以改善胰腺导管腺癌的治疗。