XiaoMi-AI文件搜索系统
World File Search System利用色谱法分析药物杂质:靶向和非靶向方法
3.4 液相色谱-高分辨率质谱法对富马酸比索洛尔杂质进行分析:使用合成反应矩阵和一般未知物比较筛选的靶向和非靶向方法的组合................................................................................................................................ 61
确定药品中的元素杂质
•草药产品•过敏提取物•放射性药物•疫苗•细胞代谢物•DNA产品•全血,细胞血成分和血细胞衍生物;等离子体/等离子体衍生物•透析解决方案•故意包括用于治疗益处的要素 div>
药物物质中的亚硝胺杂质 / LCMSTM-9030
引言自2018年起,美国FDA和其他国家的监管机构已警告某些原料药和产品中存在N-亚硝胺杂质。亚硝胺(NSA,见表1)是有毒化学物质,其中一些例如NDMA和NDEA被归类为可能的人类致癌物。NDMA和NDEA首次发现存在于血管紧张素II受体阻滞剂(ARB),如氯沙坦等原料药和产品中。在雷尼替丁和二甲双胍药品中发现了NDMA,由于NDMA含量超过可接受摄入量限值(AI,96 ng/天),因此产品被召回。利用高灵敏度和选择性的GC-MS、LC-MS/MS [1]和LC-HRMS [2-4]质谱方法,可以对药品中痕量NDMA和其他有关亚硝胺进行检测和定量。
金属杂质的溶解行为以及通过添加螯合剂的恢复半导体晶圆清洁的改善
作为晶圆清洁过程,RCA(美国无线电公司)清洁主要使用。但是,RCA清洁存在诸如洗澡生活不稳定,重新吸附杂质和高温清洁等问题。在此,我们试图通过使用螯合剂(草酸)解决这些问题来提高硅晶片的纯度。通过参考Pourbaix图,可以鉴定出由清洁液和每个金属粉之间反应产生的化合物。所有金属在反应前均表现出10μm或更高的粒径分布,但反应后的粒径分布为500 nm。在适当的情况下,可以证实反应前后的金属显示出不同的吸光度。由于通过这种清洁溶液清洗了回收硅晶片表面的元素分析,因此证实除了SI以外,未检测到其他次级。关键字:回收硅晶片,晶圆清洁,金属杂质,金属复合物,螯合剂
药物中的杂质亚硝胺;健康风险评估与缓解研讨会第一天
• 已知的 300 多种 NOC 在动物实验中超过 90% 具有致癌性。• NDMA、NDEA 和烟草特有的 NOC(如 NNK)对非常广泛的动物物种产生致癌作用,甚至包括亚人类灵长类动物。没有发现任何物种具有抗性。• 结构-活性研究有助于确定导致致癌性的结构元素,反之亦然,有助于确定消除致癌性的结构元素。• NOC 的有机向性作用是此类化合物的一个特征:肿瘤可在靶器官中特异性诱发,包括肺、鼻腔、食道、胃、胰腺、结肠、膀胱、中枢神经系统。• NOC 的生物活化及其与关键细胞靶标的相互作用在动物和人体组织中基本相似。
和内部带和内部杂质相关的吸收(in,ga)n/ ... div>
摘要。在本文中,我们从理论上研究了内部井组成,大小和杂质在gan/(ga)N/gan n/gan杂质结构中的内部井组成和杂质的位置以及传导带光吸收。基于数值有限的元素方法(FEM),考虑到井及其周围矩阵之间的介电常数和有效的质量不匹配,为有限的潜在屏障求解了杂质相关的schrödinger方程。我们的结果表明,吸收由偶极基矩阵元素以及初始和最终的状态过渡能强烈控制。对于固定的屏障宽度,发现吸收光谱被发现红移(蓝移),井宽度增加(浓度)。还表明,与中心相比,杂质的吸收现象对于中心的情况更为明显。我们得出的结论是,需要正确控制这些参数,以充分理解太阳能电池应用的光吸收。
杂质[lnln'ln]灯笼型复合物作为具有嵌入式量子误差校正
量子误差校正(QEC)是必须实现可扩展的量子计算体系结构1超出当前中间尺度噪声设备的功能的强制性。2 - 6的确,由于量子计算机与环境噪声的不可避免的相互作用,叠加状态本质上是脆弱的且容易出错的。QEC算法基于将单个逻辑量子置于多个物理对象中的编码,从而使该平台的实现和控制非常苛刻。在这方面,分子纳米磁铁(MNM)是一种特别有吸引力的材料类。7 - 10每个分子可以容纳几个可区分的量子,并具有化学定制的磁相互作用11-16,并且可以显示出非常长的相干时间。17 - 27此外,它们可以通过射频26,28,29和电子顺磁共振(EPR)脉冲来表征和操纵,这些脉冲(EPR)脉冲解决了不同的过渡,即使在表面上的单个原子上也已经探究了30个。31这里,我们建议利用这些特殊性以嵌入受保护的逻辑单元
杂质[lnln'ln]灯笼型复合物作为具有嵌入式量子误差校正
量子误差校正(QEC)对于实现可扩展的量子计算体系结构1的实现是必须的,超出了当前中等规模噪声设备的功能。2 - 6的确,由于量子计算机与环境噪声的不可避免的相互作用,叠加状态本质上是脆弱的且容易出错的。QEC算法基于将单个逻辑量子置于多个物理对象中的编码,从而使该平台的实现和控制非常苛刻。在这方面,分子纳米磁铁(MNM)是一种特别有吸引力的材料类。7 - 10每个分子可以容纳几个可区分的量子,并具有化学定制的磁相互作用11-16,并且可以显示出非常长的相干时间。17 - 27此外,它们可以通过射频26,28,29和电子顺磁共振(EPR)脉冲来表征和操纵,这些脉冲(EPR)脉冲解决了不同的过渡,即使在表面上的单个原子上也已经探究了30个。31这里,我们建议利用这些特殊性以嵌入受保护的逻辑单元
识别药品中的意外杂质
1. 在 Nelson Labs Europe,可以直接链接到 DEREK NEXUS 软件,可以通过该软件生成构效关系 (SAR) 评估报告。 2. DEREK NEXUS SAR 评估的结果可纳入完整的毒理学评价报告,该报告回顾了有关该化合物(或相关化合物)的更广泛的毒理学文献。随后,将根据药品“最坏情况”给药方案进行风险评估。这应该允许根据化合物的(预期)每日允许暴露量来验证药品中发现的杂质含量。 3. 如果没有所识别杂质的毒理学数据,Nelson Labs Europe 可以全力协助您进行广泛的体外和体内毒理学测试。
二甲双胍中亚硝胺杂质的检测方法
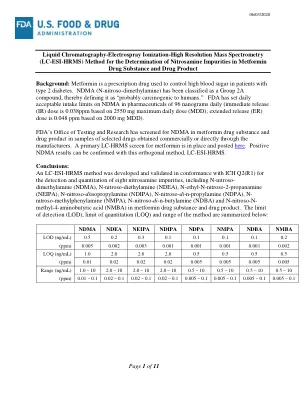
液相色谱-电喷雾电离-高分辨率质谱 (LC-ESI-HRMS) 法测定二甲双胍药物物质和药物产品中的亚硝胺杂质背景:二甲双胍是一种处方药,用于控制 2 型糖尿病患者的高血糖。NDMA(N-亚硝基二甲胺)被归类为 2A 类化合物,因此将其定义为“可能对人类致癌”。FDA 已将药品中 NDMA 的每日可接受摄入量限制为 96 纳克(基于 2550 毫克最大日剂量 (MDD),速释 (IR) 剂量为 0.038 ppm;基于 2000 毫克 MDD,缓释 (ER) 剂量为 0.048 ppm)。FDA 检测与研究办公室已在通过制造商商业购买或直接获得的选定药品样品中筛查了二甲双胍药物物质和药物产品中的 NDMA。已建立二甲双胍的初级 LC-HRMS 筛选并发布于此处。可以使用正交方法 LC-ESI-HRMS 确认阳性 NDMA 结果。结论:根据 ICH Q2(R1) 开发并验证了一种 LC-ESI-HRMS 方法,用于检测和定量二甲双胍药物物质和药物产品中的八种亚硝胺杂质,包括 N-亚硝基二甲胺 (NDMA)、N-亚硝基二乙胺 (NDEA)、N-乙基-N-亚硝基-2-丙胺 (NEIPA)、N-亚硝基二异丙胺 (NDIPA)、N-亚硝基二正丙胺 (NDPA)、N-亚硝基甲基苯胺 (NMPA)、N-亚硝基二正丁胺 (NDBA) 和 N-亚硝基-N-甲基-4-氨基丁酸 (NMBA)。该方法的检测限(LOD)、定量限(LOQ)和范围总结如下:







![杂质[lnln'ln]灯笼型复合物作为具有嵌入式量子误差校正](/simg/5/595c89d5e85346d0da1503c4ef433e52b56f51ab.webp)
![杂质[lnln'ln]灯笼型复合物作为具有嵌入式量子误差校正](/simg/7/7d0ef248ff9f803aab7d3cbd75e0b51e7a9442b0.webp)