XiaoMi-AI文件搜索系统
World File Search System分子生物学的中心法则
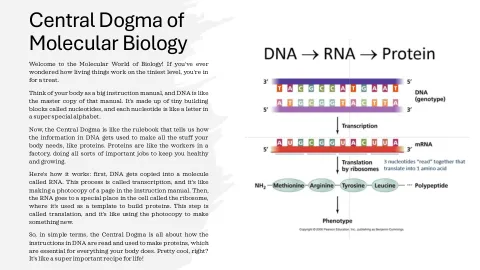
它的工作原理如下:首先,DNA 被复制到一个叫做 RNA 的分子中。这个过程叫做转录,就像是复印说明书中的一页。然后,RNA 进入细胞中一个叫做核糖体的特殊位置,在那里它被用作构建蛋白质的模板。这一步叫做翻译,就像是利用复印件制造新的东西。
利用寡核苷酸荧光原位杂交 (FISH) 探针对西伯利亚野黑麦 (Elymus sibiricus L.) 进行分子核型分析
西伯利亚野黑麦 (Elymus sibiricus L.) 是一种异源四倍体物种,是一种原产于温带地区的潜在优质多年生牧草作物。我们利用代表 10 个重复序列的荧光结合寡核苷酸,包括 6 个微卫星重复序列、2 个卫星重复序列和 2 个核糖体 DNA,通过连续荧光原位杂交和基因组原位杂交分析来表征 E . sibiricus 染色体。我们的结果表明,微卫星重复序列 ( AAG ) 10 或 ( AGG ) 10 、卫星重复序列 pAs1 和 pSc119.2 以及核糖体 5S rDNA 和 45S rDNA 是唯一染色体的特异性标记。通过进一步的多态性筛选,在不同 E .西伯利亚小麦品种的基因组多态性分析采用 (AAG) 10、Oligo-pAs1 和 Oligo-pSc119.2 探针混合物。不同基因组和不同个体染色体之间的染色体多态性各不相同。特别是在种群内和种群间鉴定出 H 基因组中两种不同形式的 E 染色体。本文讨论了这些结果对西伯利亚小麦基因组研究和育种的意义,以及改进基于荧光原位杂交的核型分析的新方法。
抗生素和选择性线粒体抑制剂对培养中的恶性疟原虫的氧气和时间依赖性影响
几种抑制 70S 核糖体蛋白质合成的抗生素,包括克林霉素、吡利霉素、4'-戊基-N-去甲基克林霉素、四种四环素、氯霉素、甲砜霉素和红霉素,在培养中对恶性疟原虫具有抗疟作用,这种作用受药物暴露时间和氧张力的影响很大。在 96 小时的孵育中,效力在前 48 小时内增加高达 106 倍,在 15% 02 与 1% 02 中增加高达 104 倍。两种氨基糖苷类药物,卡那霉素和妥布霉素,没有抗疟活性。抑制核酸合成的利福平和萘啶酸与 70S 抑制剂不同。线粒体抑制剂 Janus Green、罗丹明 123、抗霉素 Al 和 8-甲基氨基-8-去甲基核黄素的活性受暴露时间和氧张力的影响。含喹啉的抗疟药、离子载体和其他抗疟药受暴露时间的影响较小,但不受氧张力的影响。这些数据可以用以下假设来最好地解释:抗疟 70S 核糖体特异性蛋白质合成抑制剂通过作用于线粒体对寄生虫产生毒性。
有哪些不同的基因治疗方法?
RNA 疗法是使用 RNA 形式的较短遗传物质序列来治疗或预防疾病。由于 RNA 序列和大小的类型很多,会影响细胞功能,因此 RNA 疗法有很多种类型。这些类型包括 mRNA、ASO、miRNA、核糖体 RNA、siRNA 和 tRNA。这些疗法通常涉及基因沉默,即沉默基因以阻止其产生有毒蛋白质。这些类型的疗法通常需要重复给药,因为它们不会永久改变我们的任何 DNA。
人类 DHFR2 基因的差异翻译能力表明存在低丰度的发育和组织特异性内源性蛋白质
根据预测翻译蛋白的重组版本的酶活性,人类二氢叶酸还原酶 2 ( DHFR2 ) 基因已被归因于功能性作用。然而,其体内功能仍不清楚。DHFR2 与其亲本同源物 DHFR 之间的高氨基酸序列同一性 (92%) 使内源性蛋白质的分析具有挑战性。本文介绍了一种针对几种人类细胞系和组织类型的靶向质谱蛋白质组学方法,以识别 DHFR2 特异性肽作为其翻译的证据。我们提供了确凿的证据,表明线粒体中的 DHFR2 活性实际上是由 DHFR 而不是 DHFR2 介导的。 Ribo-seq 数据分析和使用蔗糖垫进行的核糖体关联实验评估表明,Ensembl 注释的 DHFR2 的两个主要 mRNA 异构体 201 和 202 与核糖体存在不同的关联。这表明它在 RNA 和蛋白质水平上都发挥着功能性作用。然而,尽管 DHFR2 的各种 RNA 异构体相对丰富,但我们无法在大多数细胞类型中检测到可检测水平的 DHFR2 蛋白。我们确实在胚胎心脏中检测到了 DHFR2 特异性肽,这表明该蛋白质可能在胚胎发生过程中发挥特殊作用。我们认为 DHFR2 基因在成体细胞中的主要功能很可能出现在 RNA 水平上。
单细胞和表观遗传数据的可解释深度学习揭示了衰老方面的新分子见解
深度学习 (DL) 和可解释人工智能 (XAI) 已成为强大的机器学习工具,可用于识别空间或时间域中的复杂预测数据模式。在这里,我们考虑将 DL 和 XAI 应用于大型组学数据集,以便在分子水平上研究生物衰老。我们开发了一种先进的多视图图级表示学习 (MGRL) 框架,该框架整合了先前的生物网络信息,以细胞类型分辨率构建分子衰老时钟,随后我们使用 XAI 对其进行解释。我们将该框架应用于最大的单细胞转录组数据集之一,该数据集包含来自 981 名捐赠者的一百万多个免疫细胞,揭示了一个核糖体基因子网络,其表达与年龄无关,与细胞类型无关。将相同的 DL-XAI 框架应用于分类单核细胞的 DNA 甲基化数据,揭示了一种表观遗传失调的炎症反应途径,其活性随着年龄的增长而增加。我们表明,如果我们使用更标准的机器学习方法,就不会发现核糖体模块和炎症途径。总之,这里介绍的计算深度学习框架说明了深度学习与可解释的人工智能工具相结合如何揭示对复杂衰老过程的新颖生物学见解。
SARS-CoV-2 前导序列和 NSP1 的关键特征是病毒逃避 NSP1 介导的抑制所必需的
SARS-CoV-2 是当前全球大流行的罪魁祸首,它必须克服所有病毒都面临的难题。为了实现自身的复制和传播,它同时依赖和破坏细胞机制。在感染的早期阶段,SARS-CoV-2 表达病毒非结构蛋白 1 (NSP1),它通过阻断核糖体上的 mRNA 进入通道来抑制宿主翻译;这会干扰细胞 mRNA 与核糖体的结合。另一方面,病毒 mRNA 克服了这种阻断。我们表明 NSP1 增强了含有 SARS-CoV-2 前导序列的 mRNA 的表达。病毒前导序列中的第一个茎环 (SL1) 对于这种增强机制既必要又充分。我们的分析确定了 SL1 内的特定残基(位置 15、19 和 20 处的三个胞嘧啶残基)和 NSP1 内的另一个残基(R124),它们是病毒逃避所必需的,因此可能成为有希望的药物靶点。我们利用反义寡核苷酸 (ASO) 靶向 SL1,以有效且特异性地下调 SARS-CoV-2 mRNA。此外,我们使用 BioID 对 NSP1 的功能性相互作用组进行了分析,并确定了抗病毒防御途径的组成部分。因此,我们的分析表明 NSP1 抑制宿主基因表达同时增强病毒 RNA 表达的机制。该分析有助于调和文献中关于病毒避免 NSP1 沉默的机制的相互矛盾的报道。
安全评估文件准备的指南...
对于酵母和丝状真菌,建议使用WGS。应通过系统基因分析(例如,使用几个保守序列的串联来产生针对可用相关基因组的系统发育)或通过对同一物种的完整参考基因组的对准来完成身份的确认。在没有WGS数据的情况下,可以使用适合酵母/真菌组合适的歧视性基因的相似性(例如内部转录的间隔区(ITS),D1/D2区域或完全大型亚基核糖体RNA基因)。表8物种识别细节*
人类核仁由多个受限区域组成,与单个染色体相连
核仁是核糖体生物合成的位点,形成于位于五条人类近端着丝粒染色体 HSA13、HSA14、HSA15、HSA21 和 HSA22 的 p 臂上的 NOR 周围(图 1A;McStay 2016)。rDNA 阵列序列以及近端和远端连接(PJ 和 DJ)在所有五个近端着丝粒之间共享(Floutsakou 等人 2013;van Sluis 等人 2019)。DJ 是功能性 NOR 元件,嵌入核仁周围异染色质 (PNH) 中(Floutsakou 等人 2013)。在中期,NOR 由 UBF(上游结合因子)标记,UBF 是一种核仁 HMG 盒蛋白,可广泛结合 rDNA 阵列(Grob 等人 2014)。当细胞退出后期时,RNA 聚合酶 I (RNA Pol I) 的转录恢复,并在单个 NOR 周围形成核仁 (Hernandez-Verdun 2011; van Sluis 等人 2020)。这些核仁融合成由三个不同区室组成的成熟核仁,反映了核糖体生物发生的阶段 (Ra š ka 等人 2006)。纤维中心 (FC) 单元包含一个或几个 UBF 负载的 rDNA 重复序列 (Yao 等人 2019)。转录发生在 FC 与新生转录本上形成的周围致密纤维成分 (DFC) 之间的界面上。