XiaoMi-AI文件搜索系统
World File Search System包装说明书 - PREHEVBRIO
处方信息重点 这些重点并未包含安全有效地使用 PREHEVBRIO 所需的所有信息。请参阅 PREHEVBRIO 的完整处方信息。 PREHEVBRIO [重组乙肝疫苗] 注射用混悬液,供肌肉注射 美国初步批准:YYYY __________________ 适应症和用途 _________________ PREHEVBRIO 适用于预防已知所有乙肝病毒亚型引起的感染。PREHEVBRIO 获准用于 18 岁及以上的成人使用。(1) _______________ 剂量和用法 ______________ 用于肌肉注射。按照 0、1 和 6 个月的时间表注射三剂(每剂 1.0 毫升)PREHEVBRIO。 (2.1, 2.2) ______________ 剂型和规格 _____________ PREHEVBRIO 是一种注射用混悬液,供肌肉注射,以单剂量小瓶供应。PREHEVBRIO 单剂量为 1.0 毫升 (3) ____________________ 禁忌症 ___________________ 之前接种任何乙肝疫苗后或对 PREHEVBRIO 的任何成分出现严重过敏反应(例如过敏反应)。(4)
依托泊苷 1. 暴露数据
依托泊苷有 50 或 100 mg 液体胶囊和 20 mg/mL 注射液两种形式。明胶胶囊中还可能含有柠檬酸、明胶、甘油、氧化铁、对羟基苯甲酸酯(乙基和丙基)、聚乙二醇 400、山梨醇和二氧化钛。注射用依托泊苷浓缩液是药物在载体中的无菌非水溶液,载体可以是苯甲醇、柠檬酸、乙醇、聚乙二醇 300 或聚山梨醇酯 80。注射用浓缩液为澄清的黄色溶液,pH 值为 3-4。注射用依托泊苷磷酸盐是一种无菌、无热原的冻干粉,含有柠檬酸钠和葡聚糖 40;用注射用水将药物稀释至 1 mg/mL 浓度后,溶液的 pH 值为 2.9(Gennaro,1995 年;美国医院处方服务处,1997 年;加拿大药学协会,1997 年;英国医学协会/英国皇家药学协会,1998 年;Editions du Vidal,1998 年;Rote Liste Sekretariat,1998 年;Thomas,1998 年)。英国药典要求限制以下杂质:4′-羧基乙基亚木脂素 P、苦基乙基亚木脂素 P、α-乙基亚木脂素 P、木脂素 P 和 4′-去甲基表鬼臼毒素(英国药典委员会,1994 年)。
Qdenga,INN-登革热四价疫苗(减毒活疫苗)
此药品需要接受额外监控。这将使我们能够快速识别新的安全信息。要求医疗保健专业人员报告任何疑似不良反应。有关如何报告不良反应,请参阅第 4.8 节。 1. 药品名称 Qdenga 注射用粉末和溶剂 Qdenga 注射用粉末和溶剂,装于预充注射器中 登革热四价疫苗(活,减毒) 2. 定性和定量组成 重构后,1 剂 (0.5 mL) 含: 登革热病毒血清型 1(活,减毒)*:≥ 3.3 log10 PFU**/剂量 登革热病毒血清型 2(活,减毒)#:≥ 2.7 log10 PFU**/剂量 登革热病毒血清型 3(活,减毒)*:≥ 4.0 log10 PFU**/剂量 登革热病毒血清型 4(活,减毒)*:≥ 4.5 log10 PFU**/剂量 *通过重组 DNA 技术在 Vero 细胞中生产。将血清型特异性表面蛋白的基因改造到登革热 2 型主链中。本产品含有转基因生物 (GMO)。# 通过重组 DNA 技术在 Vero 细胞中生产 **PFU = 空斑形成单位 有关辅料的完整列表,请参阅第 6.1 节。 3. 剂型 注射用粉末和溶剂。在重新配制之前,疫苗是白色至灰白色的冻干粉末(致密块)。溶剂是无色透明溶液。 4. 临床特点 4.1 治疗指征 Qdenga 适用于预防 4 岁以上人群的登革热。Qdenga 的使用应符合官方建议。
Boostrix-IPV,预充式注射器注射用悬浮液白喉、破伤风、百日咳(无细胞成分)和脊髓灰质炎(灭活)疫苗
• 腹泻、恶心、呕吐 • 胃痛 • 颈部、腋窝或腹股沟腺体肿胀(淋巴结肿大) • 睡眠问题 • 冷漠 • 喉咙干燥 • 疲倦 在 3-6 岁的儿童中同时接种麻疹-腮腺炎-风疹 (MMR) 或麻疹-腮腺炎-风疹-水痘 (MMRV) 疫苗 在同时接种 Boostrix-IPV 与 MMR 或 MMRV 疫苗的研究中,皮疹和上呼吸道感染(包括流鼻涕和喉咙痛)的报道很常见。与单独接种 Boostrix-IPV 的研究相比,发烧、烦躁、疲劳、食欲不振和胃肠道疾病(包括腹泻和呕吐)的报道更频繁(非常常见)。在成人、青少年和 10 岁以上儿童中进行的临床试验中出现的副作用:非常常见(接种 10 剂以上疫苗时可能会出现这些副作用):
Qdenga,INN-登革热四价疫苗(减毒活疫苗)
此药品需要接受额外监控。这将使我们能够快速识别新的安全信息。要求医疗保健专业人员报告任何疑似不良反应。有关如何报告不良反应,请参阅第 4.8 节。 1. 药品名称 Qdenga 注射用粉末和溶剂 Qdenga 注射用粉末和溶剂,装于预充注射器中 登革热四价疫苗(活,减毒) 2. 定性和定量组成 重构后,1 剂 (0.5 mL) 含: 登革热病毒血清型 1(活,减毒)*:≥ 3.3 log10 PFU**/剂量 登革热病毒血清型 2(活,减毒)#:≥ 2.7 log10 PFU**/剂量 登革热病毒血清型 3(活,减毒)*:≥ 4.0 log10 PFU**/剂量 登革热病毒血清型 4(活,减毒)*:≥ 4.5 log10 PFU**/剂量 *通过重组 DNA 技术在 Vero 细胞中生产。将血清型特异性表面蛋白的基因改造到登革热 2 型主链中。本产品含有转基因生物 (GMO)。# 通过重组 DNA 技术在 Vero 细胞中生产 **PFU = 空斑形成单位 有关辅料的完整列表,请参阅第 6.1 节。 3. 剂型 注射用粉末和溶剂。在重新配制之前,疫苗是白色至灰白色的冻干粉末(致密块)。溶剂是无色透明溶液。 4. 临床特点 4.1 治疗指征 Qdenga 适用于预防 4 岁以上人群的登革热。Qdenga 的使用应符合官方建议。
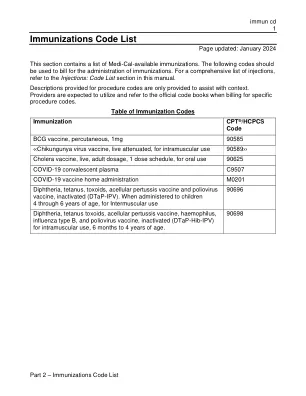
免疫接种代码表 (immun cd)
日本脑炎病毒灭活疫苗,肌肉注射用 90738 麻疹/腮腺炎/风疹病毒活疫苗 (MMR) 90707 麻疹、腮腺炎、风疹和水痘活疫苗 (MMRV) 90710 脑膜炎球菌结合疫苗,血清群 A、C、Y 和 W-135,四价(MCV4 或 MenACWY)
仅供注册医生或医院或实验室使用灭活甲型肝炎疫苗吸附IP
AVAXIM ® 80U PEDIATRIC 预充式注射器注射用混悬液 1. 药品名称 灭活甲型肝炎疫苗吸附 IP 2. 定性和定量组成 每剂 0.5 ml PFS 含有: 灭活甲型肝炎抗原…………… 80 Elisa 单位 (EU) [GBM(戈马林根村 + 患者姓名 BM)菌株,在 MRC-5 人二倍体细胞上培养] 以铝表示的氢氧化铝….. 0.15mg Al 3+ 苯氧乙醇 乙醇(50%v/v)溶液 - 2-苯氧乙醇,欧洲药典…………….. 2.5 µL - 无水乙醇,欧洲药典…………….. 2.5 µL 甲醛………………………………..12.5 µg 1x C 培养基199 Hanks(不含酚红)…………适量至 0.5mL 2.5 M 氢氧化钠…………………………………… 最高可达 pH 值 7.0±0.1 10% 盐酸………………………………………… 最高可达 pH 值 7.0±0.1 3. 官方药物形式 预充注射器中的注射用悬浮液。
国家食品药品监督管理局 (...
治疗频率 注射用哌拉西林他唑巴坦 USP 4.5 克 每六小时一次 严重肺炎 疑似因细菌感染而发热的中性粒细胞减少症成人 每八小时一次 复杂性尿路感染(包括肾盂肾炎) 复杂性腹腔内感染 皮肤和软组织感染(包括糖尿病足部感染)
2023 年第一季度业绩
片)、明复乐(注射用重组人TNK组织型纤溶酶原激活剂)、恩存(硫酸氢氯吡格雷片)、达欣宁(盐酸决奈达隆片)、阿比康(阿司匹林肠溶片)、美洛林(替格瑞洛片)