XiaoMi-AI文件搜索系统
World File Search System无进展生存期与接受转移性乳腺癌一线治疗的妇女的总体生存之间的关联:来自ESME现实世界数据库的证据
©作者2023。Open Access本文是根据Creative Commons Attribution 4.0 International许可获得许可的,该许可允许以任何媒介或格式使用,共享,适应,分发和复制,只要您对原始作者和来源提供适当的信誉,请提供与创意共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的创意共享许可中,除非在信用额度中另有说明。如果本文的创意共享许可中未包含材料,并且您的预期用途不受法定法规的允许或超过允许的用途,则您需要直接从版权所有者那里获得许可。要查看此许可证的副本,请访问http://创建ivecommons。org/licen ses/by/4。0/。Creative Commons公共领域奉献豁免(http://创建ivecommons。Org/publi cdoma in/Zero/1。0/1。0/)适用于本文中提供的数据,除非在数据信用额度中另有说明。
病例报告:MV1 Creutzfeldt-Jakob疾病的非典型年轻病例,生存期异常长
Creutzfeldt-Jakob疾病(CJD)是一种罕见的,致命的,快速进行性神经退行性疾病,是由于错误折叠的Prion蛋白(PRP)的积累而引起的。cjd每年有1-2个新人每百万个新人,零星类型占这些案件的90%。尽管发病时的中位年龄和疾病持续时间因零星CJD(SCJD)的亚型而有所不同,但该疾病通常会影响中年中位生存期为4-6个月的中年人。SCJD极为罕见。在这里,我们提出了一名21岁的女性,她因零星的prion病而死亡。她出现了精神病症状,随后是迅速进行的神经认知和运动衰落。eeg对周期性的锋利波复合物为阴性;然而,大脑MRI暗示着病毒疾病。脑脊液(CSF)实时Quaking诱导的转化率(RT-QUIC)测定不确定。尸检时的神经病理学检查显示出严重的神经元丧失和神经胶质性,继发性白质变性,但通过免疫组织化学中的小脑和新皮层中的海绵状变化和PRP沉积物最小。在Prion蛋白基因(PRNP)的密码子129上缺乏致病性突变和蛋氨酸/丝氨酸杂合性,这是不足或表现出通过蛋白质印度印度印度印度布局分析的二糖基化PRP同工型的占代表性不足的不足或表现出无需获得Prion疾病的疾病诊断而导致的PRION疾病诊断的diglycosylated PRP同种型。非常年轻的发作SCJD通常具有非典型的临床表现和疾病进展,神经病理检查结果和/或实验室测试结果可能会混淆诊断。进行彻底,全面的评估以进行准确的诊断至关重要,其中包括与组织学,prion蛋白分类和prion基因测序确定的尸检确定。
根据转录组学与转移性实体肿瘤患者生存期的相关性识别关键预后基因的中心网络枢纽
摘要背景:癌症中失调的通路可能对枢纽依赖。识别这些失调的网络并加以靶向可能会带来新的治疗选择。目标:考虑到中心枢纽与致死率增加相关的假设,识别中心网络中的关键枢纽靶标可能有助于开发出对晚期转移性实体瘤疗效更高的新型药物。设计:探索 WINTHER 试验(N = 101 名患有各种转移性癌症的患者)的转录组数据(22,000 种基因产物),其中肿瘤和正常器官匹配的组织均可用。方法:对转录组中的所有基因进行回顾性计算机模拟分析,以识别肿瘤和正常组织之间表达不同的基因(配对 t 检验),并使用生存分析(Cox 比例风险回归算法)确定它们与生存结果的关联。根据已识别基因的生物学相关性,然后确定中心网络内感兴趣的枢纽靶标。根据这些基因的表达水平对患者进行分组( K 均值聚类),并检查这些组与生存期的关联(Cox 比例风险回归算法、森林图和 Kaplan-Meier 图)。结果:我们确定了四个关键的中心枢纽基因 - PLOD3、ARHGAP11A、RNF216 和 CDCA8,与类似的正常组织相比,它们在肿瘤组织中的高表达与较差的结果具有最显著的相关性。这种相关性与肿瘤或治疗类型无关。这四种基因的组合显示出最高的显著性和与较差结果的相关性:总体生存率(风险比(95% 置信区间 (CI))= 10.5(3.43–31.9)p = 9.12E-07 在 Cox 比例风险回归模型中的对数秩检验)。在独立队列中验证了结果。结论:PLOD3、ARHGAP11A、RNF216 和 CDCA8 的表达结合起来可构成一种预后工具,与肿瘤类型和既往治疗无关。这些基因是拦截各种癌症中枢网络的潜在靶点,为新型治疗干预提供了途径。
新闻发布数据deTopotamab deruxtecan的总体生存期为14.6个月,患有晚期非小虫细胞肺癌的患者
参考文献1世界卫生组织。全球癌症天文台:肺。2024年9月访问。2 Cancer.net。 肺癌 - 非小细胞:统计。 2024年9月访问。 3个国家癌症研究所。 SEER CANCER CANCER Statistics Factsheets:肺癌和支气管癌。 2024年9月访问。 4 Chen R等。 J hematol oncol。 2020:13(1):58。 5 Majeed U等。 J hematol oncol。 2021; 14(1):108。 6 Pircher A等。 抗癌研究。 2020; 70(5):287-294。 7 Mito R等。 Pathol int。 2020; 70(5):287-294。 8Rodríguez-Abreau D等。 ann onc。 2021 Jul; 32(7):881-895。 9美国癌症学会。 针对非小细胞肺癌的靶向药物治疗。 2024年9月访问。2 Cancer.net。肺癌 - 非小细胞:统计。 2024年9月访问。 3个国家癌症研究所。 SEER CANCER CANCER Statistics Factsheets:肺癌和支气管癌。 2024年9月访问。 4 Chen R等。 J hematol oncol。 2020:13(1):58。 5 Majeed U等。 J hematol oncol。 2021; 14(1):108。 6 Pircher A等。 抗癌研究。 2020; 70(5):287-294。 7 Mito R等。 Pathol int。 2020; 70(5):287-294。 8Rodríguez-Abreau D等。 ann onc。 2021 Jul; 32(7):881-895。 9美国癌症学会。 针对非小细胞肺癌的靶向药物治疗。 2024年9月访问。肺癌 - 非小细胞:统计。2024年9月访问。3个国家癌症研究所。 SEER CANCER CANCER Statistics Factsheets:肺癌和支气管癌。 2024年9月访问。 4 Chen R等。 J hematol oncol。 2020:13(1):58。 5 Majeed U等。 J hematol oncol。 2021; 14(1):108。 6 Pircher A等。 抗癌研究。 2020; 70(5):287-294。 7 Mito R等。 Pathol int。 2020; 70(5):287-294。 8Rodríguez-Abreau D等。 ann onc。 2021 Jul; 32(7):881-895。 9美国癌症学会。 针对非小细胞肺癌的靶向药物治疗。 2024年9月访问。3个国家癌症研究所。SEER CANCER CANCER Statistics Factsheets:肺癌和支气管癌。2024年9月访问。4 Chen R等。J hematol oncol。2020:13(1):58。5 Majeed U等。J hematol oncol。2021; 14(1):108。6 Pircher A等。抗癌研究。2020; 70(5):287-294。7 Mito R等。 Pathol int。 2020; 70(5):287-294。 8Rodríguez-Abreau D等。 ann onc。 2021 Jul; 32(7):881-895。 9美国癌症学会。 针对非小细胞肺癌的靶向药物治疗。 2024年9月访问。7 Mito R等。Pathol int。2020; 70(5):287-294。8Rodríguez-Abreau D等。ann onc。2021 Jul; 32(7):881-895。9美国癌症学会。 针对非小细胞肺癌的靶向药物治疗。 2024年9月访问。9美国癌症学会。针对非小细胞肺癌的靶向药物治疗。2024年9月访问。
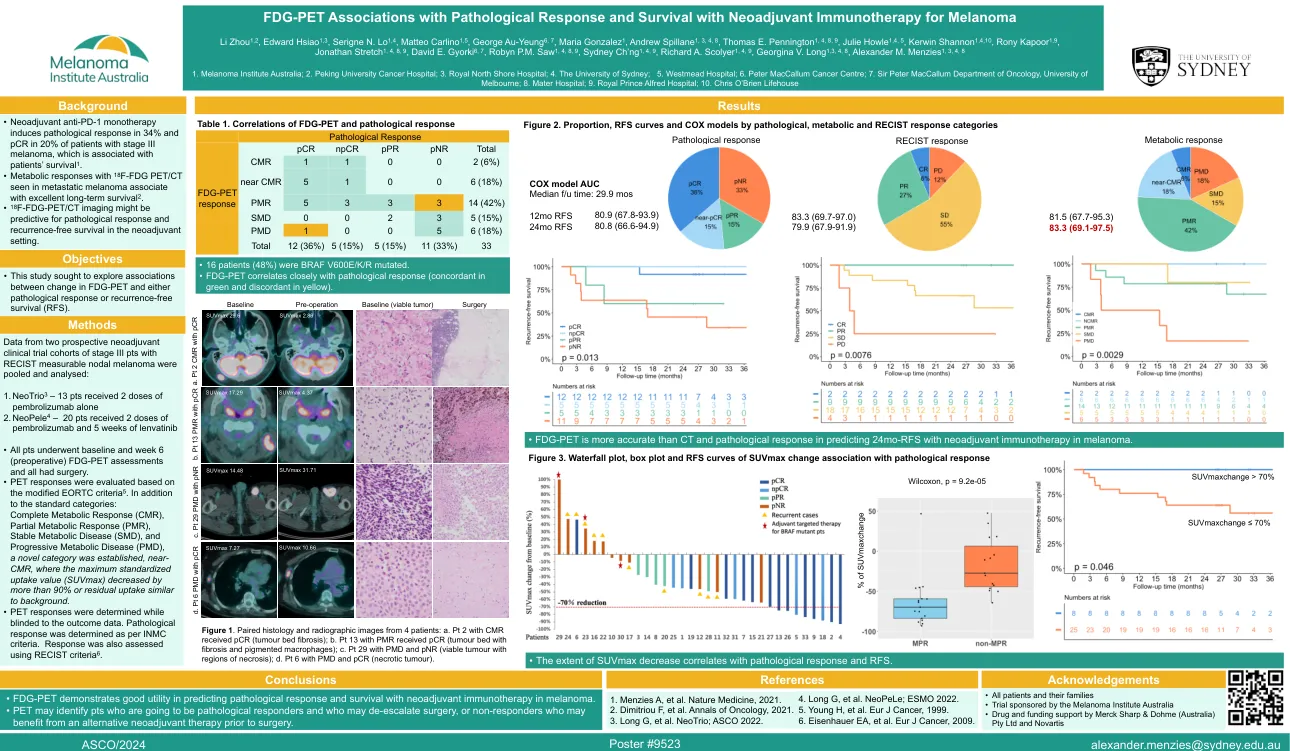
fdg-pet与病理反应和生存期与新辅助免疫疗法的黑色素疗法
修改后的EORTC标准5。除了标准类别外:完全代谢反应(CMR),部分代谢反应(PMR),稳定的代谢疾病(SMD)和进行性代谢性疾病(PMD),建立了一种新型类别,接近CMR,最大程度的标准化吸收值(SUVMAX)由超过90%的不超过90%或背景造成的最大标准化摄取值(SUVMAX)。•
病例报告:两例长期无白血病生存期的儿科病例,并通过供体CD7 CAR-T细胞治疗的急性T淋巴细胞白血病,这些细胞桥梁桥接成单倍型干细胞移植
病例表现:患者1是一个10岁的男孩,由于T-The T-All复发而造成了多种淋巴结疾病而没有不适。诱导化疗后,患者未能缓解。随后患者接受了供体(他的父亲)CD7 CAR-T细胞并达到完全缓解(CR)。第一次输注Car-T细胞后的三十天,他接受了Allo-HSCT,他的父亲也是捐助者。他的LFS> 3年。患者2是一个8岁男孩,他因发烧,咳嗽和轻度呼吸困难而被送往我们的医院。他在诱导化疗后没有获得缓解;因此,他收到了捐赠者(他的父亲)CD7 CAR-T细胞并获得了CR。CAR-T细胞输注二十六天后,患者接受了Allo-HSCT,他的父亲是捐助者。他幸免于难2年。在最后一次随访中,两个患者都活着并表现出良好的生活
机器学习分析病理图像预测小细胞肺癌患者免疫治疗1年无进展生存期
摘要 背景 在小细胞肺癌 (SCLC) 中,肿瘤免疫微环境 (TIME) 可能是免疫治疗的一个有希望的生物标志物,但客观评估 TIME 仍然具有挑战性。因此,我们旨在通过对 TIME 进行机器学习分析来开发一种预测免疫治疗效果的生物标志物。方法 我们对接受化学免疫疗法作为一线治疗的广泛期 SCLC 患者进行了一项前瞻性研究的生物标志物分析。我们使用病理图像(H&E、程序性细胞死亡配体 1 (PD-L1) 和双重免疫组织化学测定(分化簇 8 (CD8) 和叉头框 P3 (FoxP3))和患者信息训练了一个模型来预测 1 年无进展生存期 (PFS)。主要结果是机器学习模型在预测 1 年 PFS 方面的平均曲线下面积 (AUC)。结果我们分析了来自 78 名患者的 100,544 个病理图像块。患者信息、病理图像和组合模型的平均 AUC 值分别为 0.789(范围 0.571–0.982)、0.782(范围 0.750–0.911)和 0.868(范围 0.786–0.929)。在这三个模型中,高效组 PFS 均长于低效组(患者信息模型、HR 0.468,95% CI 0.287 至 0.762;病理图像模型,HR 0.334,95% CI 0.117 至 0.628;组合模型,HR 0.353,95% CI 0.195 至 0.637)。TIME 的机器学习分析比人体计数评估具有更好的准确性(人体计数的 AUC,CD8 阳性淋巴细胞:0.681,FoxP3 阳性淋巴细胞:0.626,PD-L1 评分:0.567)。结论使用机器学习对 TIME 进行空间分析可以预测 SCLC 患者的免疫治疗疗效,从而支持其作为免疫治疗生物标志物的作用。
如何引用本文 Nagai H, Karube R (2023 年 10 月 19 日) WT1 树突状细胞疫苗疗法改善免疫状况并延长无进展生存期
WT1-树突状细胞疫苗治疗从第155天开始,共注射8剂,直至第280天。通过测量迟发型超敏反应(DTH)的大小来确定对WT1抗原的细胞免疫反应强度。为了测量DTH,将0.1毫升WT1抗原皮内注射到前臂掌侧中心。该注射与WT1-DC腹股沟注射同一天进行。计算皮肤红斑长径和短径的平均值。第四次至第八次注射的DTH平均直径为74.3毫米。DTH的平均直径直到第三次注射才达到60毫米,但从第四次注射开始,它就超过了60毫米,第四次至第八次注射后的平均DTH为74.3毫米。
新闻稿 Datopotamab Deruxtecan 相对于化疗可改善既往接受过治疗的非小细胞肺癌患者的无进展生存期
总体试验人群 Datopotamab Deruxtecan (n=299) 多西他赛 (n=305) 中位 PFS (月) i (95% CI) 4.4 个月 (4.2-5.6) 3.7 个月 (2.9-4.2) 风险比 (95% CI) 0.75 (0.62-0.91) p 值 ii p=0.004 中位 OS (月) (95% CI) iii 12.4 个月 (10.8-14.8) 11.0 个月 (9.8-12.5) 风险比 (95% CI) 0.90 (0.72-1.13) ORR (已确认),% (95% CI) i, iv 26.4% (21.5-31.8) 12.8% (9.3-17.1) CR 率, % 1.3% 0% PR 率,% 25.1% 12.8% 中位 DoR(月)i (95% CI) 7.1 个月 (5.6-10.9) 5.6 个月 (5.4-8.1) 非鳞状组织学 Datopotamab Deruxtecan (n=229) 多西他赛 (n=232) 中位 PFS(月)i (95% CI) 5.6 个月 (4.4-7.0) 3.7 个月 (2.9-4.2) 风险比 (95% CI) 0.63 (0.51-0.78) OS 风险比 (95% CI) 0.77 (0.59-1.01) ORR(已确认),% i, iv 31.2% 12.8% 中位 DoR(月)i 7.7 个月5.6 个月 鳞状组织学 Datopotamab Deruxtecan (n=70) 多西他赛 (n=73) 中位 PFS (月) i 2.8 个月 (1.9-4.0) 3.9 个月 (2.8-4.5) 风险比 (95% CI) 1.38 (0.94-2.02) OS 风险比 (95% CI) 1.32 (0.87-2.00) ORR (%) i, iv 9.2% 12.7%
PARP抑制剂和卵巢癌的总生存期,在所有情况下都建议重新评估
卵巢癌中的抽象PARP抑制剂一直是过去十年的突破性疗法,受到积极试验结果的驱动,并得到了原始药理原理的支持。然而,有了成熟的数据,有害的生存结果导致2022年在美国食品和药物管理局(FDA)中最先进的环境指示中所有认可的PARP抑制剂(作为第三或后续行中的单一疗法)中的所有批准的PARP抑制剂。还限制了另外两个迹象,作为复发后的维护。在这项工作中,基于每种环境中汇总的荟萃分析,我们质疑Oncol-Ogy的独特情况:在前线环境中可以看到生存益处,同时,以后线的生存下降。这一原始特征是由PARP抑制剂的独特生物学作用(通过合成致死性)在卵巢癌和同源修复缺乏的患者中解释的。另一种解释可能是试验设计:以后的线减少可以部分解释为什么在早期环境中看到有益的结果,只是避免了这些试验中实验组中PARP抑制剂的晚期暴露。在某些试验中看到的高跨界率进一步支持了这一替代假设。 我们认为,我们的分析和最新的PARP抑制剂生存结果值得重新评估这些化合物在卵巢癌治疗景观中的位置。在某些试验中看到的高跨界率进一步支持了这一替代假设。我们认为,我们的分析和最新的PARP抑制剂生存结果值得重新评估这些化合物在卵巢癌治疗景观中的位置。