XiaoMi-AI文件搜索系统
World File Search System调节 EZH2 活性可诱导甲状腺未分化癌的抗肿瘤作用和细胞再分化
摘要:间变性甲状腺癌 (ATC) 是一种罕见且致命的甲状腺癌,迫切需要研究与其侵袭性生物学相关的新分子靶点。在此背景下,在侵袭性实体肿瘤中经常观察到多梳抑制复合物 2/EZH2 的过度激活,从而诱导染色质压缩,这使得 EZH2 甲基转移酶成为治疗的潜在靶点。然而,染色质可及性的失调在甲状腺癌中尚未得到充分研究。在本研究中,EZH2 表达受 CRISPR/Cas9 介导的基因编辑调节,并用 EZH2 抑制剂 EPZ6438 单独或与 MAPK 抑制剂 U0126 联合使用进行药理学抑制。结果表明,CRISPR/Cas9 诱导的 EZH2 基因编辑在体外降低了细胞生长、迁移和侵袭,当将 EZH2 编辑的细胞注射到免疫功能低下的小鼠模型中时,肿瘤生长减少了 90%。肿瘤的免疫组织化学分析显示,与对照肿瘤相比,EZH2 编辑肿瘤中的肿瘤细胞增殖减少,癌症相关成纤维细胞的募集减少。此外,EZH2 抑制诱导了甲状腺分化基因的表达和 ATC 细胞中的间充质-上皮转化 (MET)。因此,这项研究表明,针对 EZH2 可能是一种有前途的 ATC 新辅助治疗方法,因为它可以促进体外和体内的抗肿瘤作用并诱导细胞分化。
纤连蛋白通过EGR1在甲状腺癌中有助于BRAF抑制剂驱动的侵入性表型,可以通过抑制ERK1/2
BRAF中的突变在晚期乳头状和甲状腺甲状腺癌(PTC和ATC)中很常见。但是,BRAF突变的PTC患者目前缺乏针对此途径的疗法。尽管BRAF和MEK1/2对BRAF-突变ATC患者的批准组合,但这些患者经常进展。因此,我们筛选了一组BRAF突变甲状腺癌细胞系,以识别新的治疗策略。我们表明甲状腺癌细胞具有抗BRAF抑制作用(BRAFI)的侵袭增加,并且对BRAFI的反应促进侵入性分泌组。使用反相蛋白阵列(RPPA),我们确定了响应BRAFI治疗的细胞外基质蛋白(纤连蛋白)的表达增长近2倍,而纤连蛋白纤维蛋白分泌的相应增加了1.8至3.0倍。因此,外源性纤连蛋白的添加表现出Brafi诱导的侵袭增加,而抗纤维蛋白在抗性细胞中的耗竭导致侵袭增加。我们进一步表明,BRAFI诱导的侵袭可以通过抑制ERK1/2来阻止。在抗BRAFI的患者衍生异种移植模型中,我们发现对BRAF和ERK1/2的双重抑制减慢了肿瘤的生长和循环纤连蛋白的降低。使用RNA序列,我们将EGR1鉴定为响应BRAF/ERK1/2抑制作用的顶级下调基因,并且进一步表明,对于Brafi诱导的侵袭和纤维蛋白对BRAFI的响应而言,EGR1对于BRAFI诱导的诱导诱导是必要的。
病例报告
间变性甲状腺癌 (ATC) 是一种源自甲状腺滤泡上皮细胞的未分化肿瘤。ATC 的年发病率为 1-2/1000000,占所有甲状腺癌的 1%-2%[3]。患者的预后与年龄、社会经济地位、远处转移、手术、化疗等有关 [4,5]。目前,ATC 尚无明确或标准化的治疗方法以延长患者的生存期。治疗方法包括手术、放疗、化疗、免疫治疗和靶向治疗。患者通常在疾病晚期才被诊断出来,手术难以完全切除 ATC[6]。因此,总有效率通常很低,总生存率也很低。由于预后不良和缺乏治疗,肿瘤的分子特征研究可能提供更多靶点,为患者提供更多的治疗选择[7]。我们在此总结了 ATC 患者的临床诊断和治疗。经过靶向治疗和免疫治疗后,患者的生存率明显提高。
案例报告:NRAS Q61R/ BRAF D594N突变对Dabrafenib的三重奏,TRAMETINI div>的NRAS Q61R/ BRAF D594N突变的完全反应
肿瘤甲状腺癌,BRAF非V600,NRA,联合免疫疗法和靶向治疗,病例报告。型甲状腺癌(ATC)是一种罕见的甲状腺癌,死亡率接近100%。BRAF V600和NRAS突变是ATC最常见的驱动因素。虽然可以通过BRAF靶向疗法治疗BRAF V600-Mutated ATC的患者,但没有有效的ATC治疗NRAS或非V600 BRAF突变。对于不可遗憾的驾驶员突变患者,免疫疗法提供了另一种治疗选择。在这里,我们提出了一个肿瘤PD-L1阳性(肿瘤比例评分为60%)和NRAS Q61R/ BRAF D594N突变的转移性ATC患者,该突变在PD-1抗体Sintilimab Plus Sintilimab Plus Sintilimab Plus血管生成抑制剂Anlotinib上进展。3类BRAF突变体D594N对MEK抑制剂Trametinib的抑制敏感,其致癌活性也取决于CRAF,BRAF抑制剂Dabrafenib可以抑制这种CRAF。由于这些原因,患者接受了达布拉尼,曲敏替尼和辛蒂利莫比的打捞治疗方案,这导致了完全的病理反应。据我们最大的了解,这是第一份关于与免疫疗法和靶向治疗结合结合的同时NRAS / BRAF非V600突变的ATC患者成功治疗的报告。需要进一步研究以解读dabrafenib/trametinib与PD-1抗体的结合的机制,克服了可能由并发的BRAF和NRAS突变介导的初始免疫疗法抗性。
甲状腺癌中的 P 物质和神经激肽-1 受体系统:新分子疗法的潜在靶点
摘要:近年来,人们开发出多种方法来了解甲状腺癌 (TC) 致癌的分子改变,并探索新的 TC 治疗策略。现已明确神经激肽-1 受体 (NK-1R) 在癌细胞中过度表达,并且 NK-1R 对癌细胞的生存至关重要。P 物质 (SP) 与肿瘤细胞中的 NK-1R 结合在癌症进展中起着关键作用,它促进肿瘤细胞生长、保护肿瘤细胞免于凋亡、通过增强癌细胞迁移引发侵袭和转移,并刺激内皮细胞增殖以促进肿瘤血管生成。值得注意的是,与正常甲状腺相比,所有类型的人类 TC(乳头状、滤泡状、髓样、间变性)以及转移性病变都表现出 SP 和 NK-1R 的过度表达。 TC 细胞合成并释放 SP,SP 通过自分泌、旁分泌、内分泌和神经内分泌过程发挥多种功能,包括调节肿瘤负荷。因此,TC 分泌 SP 会导致血浆中的 SP 水平升高,TC 患者的血浆 SP 水平明显高于对照组。此外,NK-1R 拮抗剂已显示出剂量依赖性的抗肿瘤作用。它们一方面抑制癌细胞增殖,另一方面诱导肿瘤细胞凋亡。此外,已证明 NK-1R 拮抗剂可抑制肿瘤细胞迁移,从而削弱侵袭性和转移能力以及血管生成。鉴于 NK-1R 在所有类型的 TC 中均持续过度表达,针对该受体代表了一种有前途的 TC 治疗方法。因此,NK-1R 拮抗剂(如阿瑞吡坦药物)可能代表用于 TC 治疗的新型药物。
现实世界使用T3来减轻
甲状腺癌是一种常见的内分泌恶性肿瘤,大多数病例被诊断为分化甲状腺癌。甲状腺切除术是甲状腺癌治疗的基石。 辅助治疗在所有已知原发性肿瘤组织和转移灶的手术切除后进行放射性碘的治疗。 放射性碘消融的准备工作需要将甲状腺刺激激素升高至30 mIU/L,以确保甲状腺卵泡细胞摄入I-131。 在印度环境中,在准备放射性碘消融方面面临特定挑战,包括重组TSH注射的高成本,这可能排除大多数患者的使用。 印度内分泌学家,内分泌外科医生和核医学医师在准备现实环境中为放射性碘消融的甲状腺切除术患者准备的实用方法需要精心阐述和编年史,以提供针对印度风景中的约束的指导。 甲状腺激素戒断受到放射性碘消融前4周的停止,导致严重的甲状腺功能减退症。 这可以通过适当使用liothyronine(LT3)替代左甲状腺素后解决。 LT3每天两次或三次MCG给药(分别剂量的40至60 mcg/天)是THW期间的最佳实践。 停止左旋甲状腺素后,LT3替换的持续时间为2-3周,然后在LT3休假10-14天。甲状腺切除术是甲状腺癌治疗的基石。辅助治疗在所有已知原发性肿瘤组织和转移灶的手术切除后进行放射性碘的治疗。放射性碘消融的准备工作需要将甲状腺刺激激素升高至30 mIU/L,以确保甲状腺卵泡细胞摄入I-131。在印度环境中,在准备放射性碘消融方面面临特定挑战,包括重组TSH注射的高成本,这可能排除大多数患者的使用。印度内分泌学家,内分泌外科医生和核医学医师在准备现实环境中为放射性碘消融的甲状腺切除术患者准备的实用方法需要精心阐述和编年史,以提供针对印度风景中的约束的指导。甲状腺激素戒断受到放射性碘消融前4周的停止,导致严重的甲状腺功能减退症。这可以通过适当使用liothyronine(LT3)替代左甲状腺素后解决。LT3每天两次或三次MCG给药(分别剂量的40至60 mcg/天)是THW期间的最佳实践。停止左旋甲状腺素后,LT3替换的持续时间为2-3周,然后在LT3休假10-14天。这些实践得到了文献证据的证实,并提出了指南的建议,阐明了甲状腺激素戒断期间使用利奥赛氨酸的使用。关键词:甲状腺激素的戒断,氟氨酸,左甲状腺素,甲状腺功能减退症,甲状腺癌区分,放射性碘消融
引用为:Hu S, Wu X, Jiang H. 1990 至 2030 年全球甲状腺癌负担趋势和预测。J Glob Health 2024;14:04084。
结果 1990 年至 2019 年,全球甲状腺癌的年龄标准化发病率 (ASIR) 有所增加,在两个研究时间点,女性的总体疾病负担均高于男性。ASIR 的男女比例从 1990 年的 0.41 增加到 2019 年的 0.51,而年龄标准化死亡率 (ASDR) 的比例从 0.60 增加到 0.82。模型预测,2020-30 年阿拉伯联合酋长国的 ASIR(估计年度百分比变化 (EAPC) = 4.19)和年龄标准化 DALY 率(EAPC = 4.36)将呈现最快的上升趋势,而圣基茨和尼维斯的 ASDR(EAPC = 2.29)将呈现最快的上升趋势。同时,预计在此期间各国的 ASDR 和年龄标准化 DALY 率的增长趋势都将增加。对 1990-2019 年和 2020-30 年全球甲状腺癌负担的相关性分析表明,在低 SDI 和中低 SDI 国家,ASIR 的增长与社会人口指数 (SDI) 之间存在显著的正相关性。
甲状腺的事实表 -
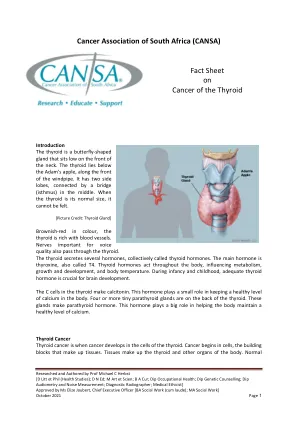
[图片来源:甲状腺]颜色棕红色,甲状腺富含血管。对语音质量重要的神经也通过甲状腺。甲状腺分泌几种激素,统称为甲状腺激素。主要激素是甲状腺素,也称为T4。甲状腺激素在整个体内作用,影响新陈代谢,生长和发育以及体温。在婴儿期和童年期间,足够的甲状腺激素对于大脑发育至关重要。甲状腺中的C细胞产生降钙素。这种激素在保持体内健康钙水平方面起着很小的作用。四个或多个微小的甲状旁腺在甲状腺的后部。这些腺体会产生甲状旁腺激素。这种激素在帮助人体保持健康的钙水平方面起着重要作用。甲状腺癌甲状腺癌是甲状腺细胞中癌症发生的。癌症始于细胞,构成组织的构件。组织构成人体的甲状腺和其他器官。正常
RET 相关肿瘤的精准肿瘤学
RET 原癌基因的异常激活与多种癌症有关。RET 获得功能点突变是多发性内分泌肿瘤 2 (MEN2) 综合征和散发性髓样甲状腺癌的驱动事件,而 RET 重排是多种非髓样甲状腺癌的驱动事件。能够抑制 RET 的药物已用于治疗 RET 突变癌症。最初使用的是多激酶抑制剂,尽管它们显示出适度的疗效和显著的毒性。然而,新的 RET 选择性抑制剂,如 selpercatinib 和 pralsetinib,最近已经过测试,并显示出良好的疗效和耐受性,即使目前还没有多激酶和选择性抑制剂之间的直接比较。高通量技术的出现已识别出除点突变和融合之外的罕见 RET 变异(包括 RET 缺失)的癌症,这引发了人们对这些变异是否具有功能性影响以及是否可以被 RET 抑制剂靶向的问题。在这篇小型综述中,我们重点关注具有 RET 缺失(包括缺失/插入 (indel))的肿瘤及其对 RET 抑制剂的反应。
嗜铬细胞瘤和副神经节瘤
PCC/PGL 是最具遗传性的肿瘤之一(详见 12–14),与 PCC/PGL 相关的种系突变存在于神经纤维瘤病 (NF-1)、多发性内分泌肿瘤 (MEN2a 和 MEN2b)、von Hippel–Lindau (VHL) 和家族性 PGL 综合征中。3 此外,发现大约 30% 的 PCC/PGL 散发病例含有已知的基因突变。早期对 PCC/PGL 肿瘤的分析集中在 MEN2A 和 MEN2B 综合征上。事实上,历史和基因分析证实,第一例报告的 PCC 是在患有 MEN2A 的患者中描述的。15,16 MEN2A 患者也表现为髓样甲状腺癌和甲状旁腺功能亢进症。与 MEN2A 患者类似,MEN2B 综合征患者也会患上 PCC 和髓样甲状腺癌;然而,他们没有患甲状旁腺功能亢进,而是患上了神经瘤(详见 17)。NF-1 患者除了神经纤维瘤外,还被确诊患有胰腺囊肿、胰腺囊肿、血管瘤和肾细胞癌。19