XiaoMi-AI文件搜索系统
World File Search SystemSidhu, N. S.、Pathy, T. L. 和 Likhithashree, T. R. 2025. MicroRNA 生物发生、机制及其在作物改良中的作用概述。Vigyan Varta
与编码基因类似,miRNA 由 RNA 聚合酶 II 从 miRNA/MIR 基因转录成长的初级转录本,称为初级/pri miRNA(图1)。此后,pri-miRNA 被 RNaseIII 样酶(称为 DICER-LIKE (DCL 1))与其他蛋白质一起切割成前体/前 miRNA。这些前 miRNA 进一步由 DCL1 加工成 20-24 个核苷酸长的 miRNA:miRNA 双链体。然后,双链体在 3' 端被 HUA 增强子 1 甲基化,并通过 EXPORTIN-5 输出到细胞质中。然后将双链体加载到含有 ARGONAUTE (AGO) 蛋白的 RNA 诱导沉默复合物 (RISC) 中。来自 miRNA:miRNA 双链中只有一条 RNA 链被加载到 RISC 上,而另一条链被小 RNA 降解核酸酶降解。最后,加载的 miRNA 将 RISC 靶向其互补的 mRNA,因此,根据其与目标 mRNA 的互补程度,它可能导致两种结果。如果 miRNA 与目标 mRNA 高度同源,则可能导致 mRNA 的位点特异性裂解,而与目标 mRNA 的弱碱基配对则导致翻译抑制(图1)。
通过对引导 RNA 进行位点特异性化学修饰来光控制 CRISPR/Cas9 功能
RNA 引导的 CRISPR/Cas9 系统是一种强大的基因组编辑工具箱,源自原核生物获得性免疫系统 1,过去几年在生物学研究和治疗应用方面受到越来越多的关注。2-5 CRISPR/Cas9 的基因组位点靶向能力依赖于向导 RNA(gRNA)间隔区与基因组 DNA 之间的碱基配对。6 核酸酶失活 Cas9(dCas9)消除了核酸酶活性,但保留了 DNA 靶向能力,已被重新利用,通过采用不同的蛋白质效应 7 例如基因激活和抑制、8,9 基因组位点成像、10,11 核碱基编辑 12,13 和表观遗传修饰,进一步扩展了 CRISPR/Cas9 系统的应用场景。 14,15 与持续活跃的 RNA - Cas9 复合物相比,开发条件控制的 CRISPR 功能尤其令人感兴趣,因为其活性可以以所需的空间和时间方式受到限制,从而实现对基因组的精确操作,同时减少副作用。16 可以通过合理设计 (d)Cas9 或 gRNA 来实现条件控制。(d)Cas9 蛋白的活性可以通过小分子诱导
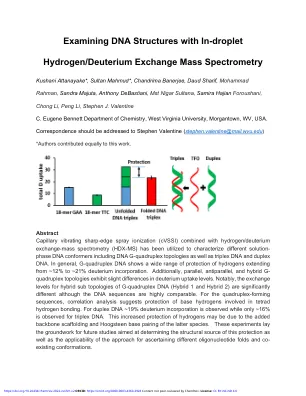
用耗油氢检查DNA结构/ ... div>
抽象的毛细管振动锋利的喷雾电离(CVSSI)与氢/氘交换型 - 质量质谱法(HDX-MS)相结合,已用于表征不同的溶液 - 溶液 - 相位DNA构型,包括DNA G- QuAdruplex拓扑以及Triplex DNA和DNA和DNA和DNA。通常,G-四链体DNA显示出广泛的氢元素范围从约12%延伸至〜21%的氘掺入。另外,平行,反平行和杂化g-四链体拓扑表现出在氘吸收水平上的略有差异。值得注意的是,尽管DNA序列高度可比性,但G-四链体DNA(杂化1和杂交2)的杂交子拓扑的交换水平显着差异。对于四链体形成序列,相关分析表明保护参与四氢键的碱基氢。对于双链DNA 〜19%氘掺入,而对于三个人,仅观察到〜16%。对氢的保护增加可能是由于后一种物种的骨架脚手架脚手架和Hoogsteen碱基配对所致。这些实验为未来的研究奠定了基础,旨在确定该保护的结构来源,以及该方法的适用性,以确定不同的寡核苷酸褶皱和共同构型。
DNA四链体
摘要 Sen 和 Gilbert [Nature, (1988) 334, 364- 366] 证实,来自人类免疫球蛋白开关区的富含鸟嘌呤的单链 DNA 能够自我结合形成稳定的四链平行 DNA 结构。拓扑异构酶 11 不会切割单链 DNA 分子。令人惊讶的是,当该 DNA 序列退火为四链结构时,该酶确实会切割相同的 DNA 序列。观察到的两个切割位点与该 DNA 分子与互补分子配对以形成正常 B-DNA 双链时发现的位点相同。这些切割被证实是蛋白质连接的,并且可以通过添加盐来逆转,这表明拓扑异构酶 11 的反应机制正常。此外,由互补寡核苷酸与四链结构结合而形成的八链 DNA 分子也被拓扑异构酶 11 切割,尽管该分子对限制性内切酶消化具有抗性。这些结果表明,单链 DNA 可能具有引导拓扑异构酶 11 到达结合位点的序列信息,但该位点必须以正确的方式进行碱基配对才能做到这一点。四链 DNA 分子能够作为酶的底物这一事实进一步表明,这些 DNA 结构可能存在于细胞中。
通过裂域 CRISPR-Cas12a gRNA 开关进行序列独立的 RNA 传感和 DNA 靶向
CRISPR 技术越来越需要对核酸酶活性进行时空和剂量控制。一种有前途的策略是将核酸酶活性与细胞的转录状态联系起来,通过设计引导 RNA (gRNA) 使其仅在与“触发”RNA 复合后发挥作用。然而,标准的 gRNA 开关设计不允许独立选择触发和引导序列,从而限制了 gRNA 开关的应用。在这里,我们展示了 Cas12a gRNA 开关的模块化设计,它可以将这些序列的选择分离。Cas12a gRNA 的 5' 端融合到两个不同且不重叠的结构域:一个与 gRNA 重复碱基配对,阻止 Cas12a 识别所需的发夹结构的形成;另一个与 RNA 触发物杂交,刺激 gRNA 重复的重新折叠和随后的 gRNA 依赖性的 Cas12a 活性。使用无细胞转录翻译系统和大肠杆菌,我们表明设计的 gRNA 开关可以响应不同的触发因素并靶向不同的 DNA 序列。调节传感域的长度和组成会改变 gRNA 开关的性能。最后,gRNA 开关可以设计为感知仅在特定生长条件下表达的内源性 RNA,从而使 Cas12a 靶向活性依赖于细胞代谢和压力。因此,我们的设计框架进一步使 CRISPR 活性与细胞状态挂钩。
通过裂域 CRISPR–Cas12a gRNA 开关进行序列独立的 RNA 传感和 DNA 靶向
CRISPR 技术越来越需要对核酸酶活性进行时空和剂量控制。一种有前途的策略是将核酸酶活性与细胞的转录状态联系起来,通过设计引导 RNA (gRNA) 使其仅在与“触发”RNA 复合后发挥作用。然而,标准的 gRNA 开关设计不允许独立选择触发和引导序列,从而限制了 gRNA 开关的应用。在这里,我们展示了 Cas12a gRNA 开关的模块化设计,它可以将这些序列的选择分离。Cas12a gRNA 的 5' 端融合到两个不同且不重叠的结构域:一个与 gRNA 重复碱基配对,阻止 Cas12a 识别所需的发夹结构的形成;另一个与 RNA 触发物杂交,刺激 gRNA 重复的重新折叠和随后的 gRNA 依赖性的 Cas12a 活性。使用无细胞转录翻译系统和大肠杆菌,我们表明设计的 gRNA 开关可以响应不同的触发因素并靶向不同的 DNA 序列。调节传感域的长度和组成会改变 gRNA 开关的性能。最后,可以设计 gRNA 开关来感知仅在特定生长条件下表达的内源性 RNA,从而使 Cas12a 靶向活性依赖于细胞代谢和压力。因此,我们的设计框架进一步使 CRISPR 活性与细胞状态挂钩。
FXN 通过间接效应表达
弗里德赖希共济失调是一种无法治愈的疾病,由 frataxin (FXN) 蛋白缺乏引起,主要由 FXN 基因内含子 1 中的 GAA 重复扩增引起。在这里,我们鉴定了与 FXN 前 mRNA 第一个内含子内的两个区域互补的反义寡核苷酸 (ASO),它可以使患者成纤维细胞中的 FXN mRNA 增加约 2 倍。通过在每个区域鉴定多个重叠的 FXN 激活 ASO、两个独立的 RNA 定量分析和多个管家基因的标准化,证实了 FXN mRNA 的增加。对删除 ASO 结合位点的细胞进行的实验表明,ASO 诱导的 FXN 激活是由间接效应驱动的。 RNA 测序分析表明,两种 ASO 诱导了相似的转录组范围变化,与野生型细胞的转录组不同。这种 RNA 测序分析未识别出 ASO 之间共有的直接碱基配对脱靶基因。错配研究确定了 ASO 中 FXN 激活所需的两个富含鸟苷酸的基序 (CCGG 和 G 4 )。我们的 ASO 的磷二酰胺吗啉寡聚体类似物不会激活 FXN,这表明存在 PS 骨架介导的效应。我们的研究表明,在采用基因激活等新机制的寡核苷酸研究中,多个详细的对照实验和靶标验证非常重要。
释放化学修饰肽核酸在 RNA 治疗中的潜力
RNA 疗法已成为治疗多种疾病的下一代疗法。与小分子不同,RNA 靶向药物不受蛋白质上结合口袋可用性的限制,而是利用沃森-克里克 (WC) 碱基配对规则来识别靶 RNA 并调节基因表达。反义寡核苷酸 (ASO) 是一种治疗由基因改变引发的疾病的强大治疗方法。ASO 识别靶 RNA 上的同源位点以改变基因表达。九种单链 ASO 已获准用于临床,几种候选药物正在针对罕见疾病和常见疾病进行后期临床试验。已经研究了几种化学修饰,包括硫代磷酸酯、锁核酸、磷二酰胺、吗啉和肽核酸 (PNA),以实现有效的 RNA 靶向。PNA 是合成的 DNA 模拟物,其中脱氧核糖磷酸骨架被 N-(2-氨基乙基)-甘氨酸单元取代。PNA 的中性假肽骨架有助于增强结合亲和力和高生物稳定性。 PNA 与靶 RNA 中的互补位点杂交,并通过基于空间位阻的机制发挥作用。在过去的三十年中,人们探索了各种 PNA 设计、化学修饰和递送策略,以证明其作为有效且安全的 RNA 靶向平台的潜力。本综述涵盖了 PNA 介导的编码和非编码 RNA 靶向在众多治疗应用中的进展。
具有不受束缚的逆转录酶和环状 RNA 模板的分裂引物编辑器
Es 可实现删除、插入和碱基替换而不会造成双链断裂 1 。然而,目前的 PE2、PE2* 和 PEmax 效应物(nCas9 与 Moloney 鼠白血病病毒 RT(M-MLV RT)的融合)1 – 3 > 6.3 千碱基 (kb),超出了 AAV 的包装能力。高产量生产如此大的蛋白质或 mRNA(用于核糖核蛋白 (RNP) 或 RNA 递送)也是一项挑战。尽管一些拆分策略已用于递送 Cas9 相关基因组编辑工具 4 ,包括拆分内含肽 5 – 7 和 MS2(参考文献 8 – 10)或 SunTag 11 系链,但大多数拆分方法才刚刚开始应用于 PE 2、12、13。这些元素增加了 PE 系统的尺寸、分子复杂性以及生产和递送负担,并且限制了 PE 开发的组合吞吐量(即核酸酶和 RT 成分的混合和匹配)。pegRNA 优化对于有效的引物编辑也很重要。当前的 pegRNA 是一种结合 RNA,由 sgRNA 和包含 RT 模板 (RTT) 和引物结合位点 (PBS) 的 3′ 延伸组成。尽管在 PE 系统中整合 RNA 分子很简单,但由于 PBS 和间隔区之间不可避免的碱基配对以及潜在的 RTT-支架相互作用,它容易发生 RNA 错误折叠。最后,pegRNA 中的 3′ 末端延伸暴露在外,易受核酸酶降解,这可能会损害 pegRNA 的完整性。虽然 3′ 末端二级结构提高了 pegRNA 的稳定性 14 ,但仍需要进一步努力减少 pegRNA 的错误折叠和不稳定性。
一种新型的蜂窝物流
为了发挥生物功能,细胞必须确保顺利执行其物流计划,以便将必要的分子货物准时运送到预定目的地。细胞中大多数已知的运输机制都基于要运输的货物与将货物运送到目的地的耗能马达蛋白之间的特定相互作用。由马克斯普朗克生物化学研究所的 Petra Schwille 和慕尼黑大学统计与生物物理学系主任、物理学家 Erwin Frey 领导的一组研究人员首次证明,即使在没有分子马达的情况下,细胞中也可以进行一种定向粒子运输形式。此外,这种机制可以根据大小对运输的粒子进行分类,正如团队在最新一期的《自然物理学》杂志上报道的那样。这项研究的重点是大肠杆菌中的 MinDE 系统,大肠杆菌是生物模式形成的成熟且重要的模型。 MinD 和 MinE 两种蛋白质在杆状细胞的两极之间振荡,它们在细胞膜上的相互作用最终将细胞分裂平面限制在细胞中心。在这种情况下,研究人员使用纯化的 Min 蛋白和人造膜在试管中重建了形成图案的 MinDE 系统。正如之前实验所预期的那样,当将富含能量的分子 ATP 添加到该系统中时,Min 蛋白重现了细菌细胞中看到的振荡行为。更重要的是,实验人员继续证明,许多不同类型的分子在穿过膜时可能会被振荡波捕获——甚至与图案形成无关且根本不存在于细胞中的分子。 DNA 折纸的分选机 为了更详细地分析运输机制,该团队转向由 DNA 折纸组成并可以锚定在膜上的货物。这种策略允许人们基于 DNA 链之间可编程的碱基配对相互作用创建不同大小和形状的分子结构。 “这些实验表明,这种运输方式取决于货物的大小,并且