XiaoMi-AI文件搜索系统
World File Search System探索胃肠道肿瘤中免疫系统与遗传学之间的动态串扰
摘要:胃肠道肿瘤(GIST)代表了癌基因成瘾的范式模型。尽管突变状态对临床结果产生了众所周知的影响,但我们仍需要将知识扩展到影响GIST患者影响行为异质性异质性的其他因素。越来越多的研究表明,肿瘤微环境(TME)主要由肿瘤相关的巨噬细胞(TAMS)和淋巴细胞(TILS)和基质分化(SD)人群,对预后和对治疗的反应具有显着影响。有趣的是,即使当前对免疫反应在这种情况下的作用的了解仍然有限,但最近的临床前和临床数据强调了TME在GIST中的相关性,在不久的将来对临床实践的可能影响。此外,免疫检查点的表达(例如PD-L1,PD-1和CTLA-4)及其与GIST中的临床表型的关系正在成为潜在的预后生物标志物。展望未来,这些变量与要点的潜在肿瘤微环境有关,尽管仅限于仍在努力的试验,可能会导致潜在的免疫疗法使用,或者在晚期TKI-Cractory GIST中单独或与靶向治疗结合使用。本综述旨在加深对突变状态与要点免疫微环境之间潜在联系的理解。
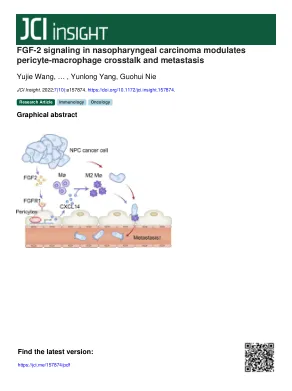
鼻咽癌中的 FGF-2 信号调节周细胞-巨噬细胞串扰和转移
引言鼻咽癌(NPC)在2018年造成73,000人死亡,东南亚的发病率最高(1,2)。鼻咽癌发展的常见因素包括爱泼斯坦-巴尔病毒(EBV)感染、遗传易感性和生活方式(2)。临床上,放疗和化疗是推荐用于早期鼻咽癌和非转移性鼻咽癌患者(3)。然而,转移性鼻咽癌患者的治疗选择有限。转移性鼻咽癌似乎是一类异质性肿瘤,生存范围广泛,肺、肝和骨是远处转移最常见的部位(4)。靶向治疗被公认为进一步延长鼻咽癌患者生存的有效方法。然而,多项临床试验表明,与常规放化疗相比,针对血管内皮生长因子 (VEGF) 信号的贝伐单抗或针对表皮生长因子 (EGF) 信号的西妥昔单抗在鼻咽癌患者中未显示出临床益处 (5–7)。因此,迫切需要开发针对鼻咽癌的新型分子靶向治疗。鼻咽癌转移机制研究是开发新型靶向治疗的基础。目前,鼻咽癌转移研究主要集中在
细胞和分子神经免疫串扰在肠道免疫中的作用
胃肠道被周围神经系统密集地支配,并由免疫系统填充。这两个系统批判性地协调了组织稳态和炎症期间外部和内部微环境的饮食,微生物和破坏刺激的感觉和适应性。大脑从肠道接收并整合了上升的感觉信号,并通过自主神经元传递降低信号回到肠道。神经元通过局部轴突反应或通过肠脑轴通过神经元电路调节肠道免疫反应。此神经免疫性串扰对于肠道稳态维持和疾病的分辨率至关重要。在这篇综述中,我们讨论了肠道粘膜免疫调节中不同类型的肠道神经元的作用。我们将重点介绍管理不同免疫细胞对宿主防御和炎症中神经信号的反应的分子机制。我们还讨论了针对神经免疫串扰肠道疾病的策略的治疗潜力。
公告第66号 令和6年8月28日
2024 年 8 月 28 日 — 零件编号或规格。面料品牌:160 尺寸盒加工类型:特殊尺寸:710x。设备名称。420x 405x。数量。4,500.00。单位。品牌。到期日期等。组。指定检验包装。SH。
太阳能串式逆变器和储能系统的电源拓扑考虑因素 (Rev. A)
如图 2-1 所示,串式逆变器中有三个主要电源块。第一级是单向 DC/DC 转换器级,可将可变的串输出转换为适用于下一级的稳定高压 DC 链路,第二级是双向 DC/DC 功率级,第三级是双向 DC/AC 逆变器级。对于单相系统,直流总线电压通常为 400V DC 。对于三相系统,直流总线电压约为 800V DC 甚至更高,可达 1500V DC 。第一个 DC/DC 级还能够对整个串执行最大功率点跟踪 (MPPT)。它只是通过改变整个串的电压和电流来搜索最大功率。然后,该直流总线电压由 DC/AC 逆变器功率级转换为电网电压电平的交流电压。在当今的系统中,AC/DC 被构建为双向 PFC/逆变器,以允许连接到电池储能系统的 DC/DC 功率级运行,并允许双向对 ESS 进行充电和放电。
肠道微生物群和宿主免疫系统之间的串扰及其对创伤性损伤的反应
数百万微生物构成了人类肠道中发现的复杂微生物生态系统。免疫系统与肠道微生物群的相互作用对于防止炎症和维持肠内稳态至关重要。可以通过肠道微生物群代谢免疫细胞和肠道上皮之间的众多代谢产物。创伤性损伤在初次犯罪后的几分钟内引起了出色而多方面的免疫反应,其中含有同时的促和抗炎性反应。改善患者结局的创新疗法的发展取决于肠道菌群和对创伤的免疫学反应。肠道微生物或肠道营养不良的构成改变也会导致免疫学反应失调,从而导致炎症。主要的人类疾病可能由于慢性营养不良以及细菌的易位和
油棕空果串纤维上有效的微生物预处理用于栽培草菇
提出利用有效微生物(EM)对油棕空果串(EFB)栽培草菇进行预处理以提高产量。观察不同EM剂量对菌丝生长和产量的影响。处理采用两个参数的组合:堆肥时间(5 天 (T1)、10 天 (T2) 和 15 天 (T3))和 EM 剂量(0% (E1)、10% (E2)、20% (E3) 和 30% (E4)。同时分析了 EFB 的成分以比较预处理前后的变化。结果显示,与其他处理相比,20% 和 30% 的 EM 预处理可显著加快菌丝生长速度。在 T2E4(10d,30% EM)下观察到 V. volvacea 的最高产量,为 271.5±57.28 g 或生物效率 (BE) 为 9.11%。在 T1E3(5d,20% EM)下获得的子实体 (FB) 平均重量最高,为 14 g,而 T2E4(10d,30% EM)下的子实体平均重量最高,为收获的 FB 数量最多,为 42。在所有测试处理中,纤维素、半纤维素和木质素均减少。EM 剂量和堆肥时间均显著影响 V. volvacea 的产量。EFB 纤维是 V. volvacea 栽培的潜在底物。
鼻咽癌中的FGF-2信号传导调节周围巨噬细胞串扰和转移
引言鼻咽癌(NPC)在2018年占73,000人死亡,东南亚的发病率最高(1,2)。通常在NPC发育中促成因素,包括爱泼斯坦 - 巴尔病毒(EBV)感染,遗传易感性和生活方式(2)。在临床上,放疗和化学疗法是针对早期NPC和非转移性NPC患者进行的(3)。但是,转移性NPC患者的治疗选择有限。转移性NPC似乎是一组具有广泛存活的肿瘤,肺,肝脏和骨骼是远处转移的最常见部位(4)。靶向治疗被认为是进一步延长NPC患者存活的有效方法。尽管如此,几项临床试验表明,与传统的化学治疗疗法相比,靶向Bevacizumab的血管内皮生长因子(VEGF)SIG-NALINing或靶向cetuximab的靶向表皮生长因子(EGF)信号传导,并未显示NPC患者的临床益处(5-7)。因此,迫切需要对NPC的Novel分子靶向疗法。NPC转移的机械研究是开发新的靶向疗法的基础。目前,NPC转移研究主要是
“肠道微生物群”串扰在多发性硬化症的发病机理中的作用
多发性硬化症(MS)是一种神经系统自身免疫性疾病,其确切的病理生理机制尚待阐明。最近的研究表明,MS的发作和进展与肠道菌群的营养不良有关。同样,大量证据表明线粒体功能障碍也可能对MS的发展产生重大影响。内共生理论发现,人线粒体的起源是微生物,并且与肠道微生物群具有相似的生物学特征。因此,肠道微生物群和线粒体功能串扰与MS的发展相关。然而,尚未完全了解肠道微生物群和线粒体功能之间的关系。因此,通过综合以前的相关文献,本文着重于肠道菌群和代谢物组成在MS的发展中的变化以及肠道微生物群和线粒体功能之间在MS进展中提供的串扰的可能机制,以提供基于此Crossst的新的治疗方法,以提供新的治疗方法,以提供新的治疗方法。
在牡蛎生命中,免疫系统和微生物群之间的串扰和相互塑造
太平洋牡蛎Crassostrea gigas居住在富含环境变化的富含微生物的海洋沿海系统中。它具有多样化和波动的微生物群,与表达多样化的免疫基因库的免疫细胞同居。在牡蛎发育的早期阶段,在受精后,微生物群在教育免疫系统中起着关键作用。在幼虫阶段暴露于丰富的微生物环境会导致牡蛎寿命中的免疫能力提高,从而在后来的少年/成人阶段更好地保护对致病感染的更好保护。这种有益的效应是与世代相传的,与表观遗传重塑有关。在少年阶段,受过教育的免疫系统参与了体内平衡的控制。尤其是,微生物群是由牡蛎抗菌肽通过特定和协同作用作用的。然而,这种平衡是脆弱的,如太平洋牡蛎死亡率综合征所示,这是一种疾病,导致全球牡蛎的大量死亡。在这种疾病中,OSHV-1 µVAR病毒对牡蛎免疫防御的削弱会诱导致命性脓毒症。本综述说明了高度多样化的牡蛎免疫系统与其在整个生命中的动态微生物群之间的持续相互作用,以及这种串扰对牡蛎健康的重要性。本文是主题问题的一部分,“雕刻微生物组:宿主因素如何确定和响应微生物定植”。