XiaoMi-AI文件搜索系统
World File Search SystemBCG 疫苗 AJV - GOV.GG - 根西岛
特殊警告和使用注意事项 疫苗应严格通过皮内途径注射。最好由接受过皮内接种技术培训的人员注射疫苗。注射不当,例如皮下或肌肉注射,会增加淋巴结炎和脓肿形成的风险。结核菌素皮肤试验阳性的人不应接种疫苗,因为这可能会导致局部反应加重。虽然过敏反应很少见,但接种疫苗期间应始终有处理过敏反应的设施。只要有可能,接种疫苗后应观察 15-20 分钟,以防发生过敏反应。 BCG 疫苗可以与灭活疫苗或活疫苗同时接种,包括麻疹、腮腺炎和风疹联合疫苗。如果不同时接种,必须经过至少 4 周的时间才能接种另一种活疫苗。在同一组中接种疫苗之前必须间隔至少 3 个月。
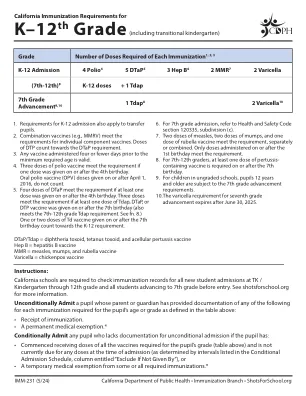
K–12 年级(包括过渡幼儿园)
1. K-12 入学要求同样适用于转校生。2. 联合疫苗(例如 MMRV)符合单剂疫苗的要求。DTP 剂量计入 DTaP 要求。3. 在最低年龄要求前四天或更短时间内接种的任何疫苗均有效。4. 如果在 4 岁生日当天或之后接种了一剂脊髓灰质炎疫苗,则三剂脊髓灰质炎疫苗符合要求。2016 年 4 月 1 日或之后接种的口服脊髓灰质炎疫苗 (OPV) 剂量不计入。5. 如果在 4 岁生日当天或之后接种了至少一剂,则四剂 DTaP 符合要求。如果在 7 岁生日当天或之后接种了至少一剂 Tdap、DTaP 或 DTP 疫苗,则三剂符合要求(也符合 7 至 12 年级的 Tdap 要求。参见脚注 8。)在 7 岁生日当天或之后接种的一剂或两剂 Td 疫苗计入 K-12 要求。
NMSIIS HL7 数据提交和消息审查
a. 组织所接种的疫苗在 NMSIIS 收到的数据中有所体现。b. 接种的疫苗具有有效且特定的 CVX/NDC 代码(而非“未指定”的 CVX 代码)。c. 历史疫苗接种具有历史上正确的 CVX 代码。d. 疫苗接种日期不得早于患者的出生日期。e. 疫苗接种日期必须早于或等于(早于或等于)提交日期。f. 每种接种的疫苗都应记录为单个疫苗接种事件(即,联合疫苗应记录为一个事件,而不是针对每种抗原的单独事件)。g. 疫苗接种日期不应与患者的出生日期相同,除非建议在出生日期接种,例如乙型肝炎。h. 制造商和 CVX/NDC 代码不应相互矛盾。i. 对于给定的疫苗类型和患者年龄,途径和地点不应相互矛盾。
疫苗安全与你的家人
如何知道接种疫苗后出现的症状是否由疫苗引起?最好的方法是进行科学研究,将一组接种疫苗的人与一组未接种疫苗但其他方面相似的人进行比较。例如,1998 年,一个英国研究小组提出,麻疹-腮腺炎-风疹 (MMR) 联合疫苗可能会导致自闭症。当时,英国大约每两千名儿童中就有一人被诊断出患有自闭症,而大约十分之九的儿童接种了 MMR 疫苗。为了确定英国研究小组关于 MMR 疫苗导致自闭症的理论是否正确,来自世界各地的研究人员研究了数十万名接种和未接种疫苗的儿童。如果疫苗会导致自闭症,那么接种疫苗的儿童中自闭症儿童的数量应该高于未接种疫苗的儿童。事实证明,接种 MMR 疫苗的儿童自闭症发病率与未接种疫苗的儿童相同。(参见“疫苗会导致自闭症吗?”)。
圣母大学医学院
2. 疫苗接种和/或免疫的证据 2.1 在接触任何患者之前,每位医学生必须有一份完整且最新的麻疹、腮腺炎、风疹 (MMR) 和水痘疫苗接种记录或对所有疫苗的血清免疫力。 • MMR 和水痘疫苗各需要 2 剂才能完成。 • 注意:这些是活疫苗,应在同一天或间隔 4 周接种。 2.2 在接触任何患者之前,每位医学生都将确认目前对乙型肝炎具有免疫力或接种疫苗后血清转化的既往史。有关说明,请参阅表 1。 2.3 任何医学生在接触儿科患者之前,必须确认最近接种过白喉、破伤风和百日咳 (DTPa) 加强疫苗。百日咳加强针应在过去 10 年内接种过。这必须持续到整个医学课程结束之后。建议如果要加强 DTPa,则接种 DTPa 和脊髓灰质炎联合疫苗。这将在学生完成儿童期计划后,作为终身预防脊髓灰质炎的加强剂。2.4 要求医学生对甲型肝炎免疫。
东北威斯康星科技学院-ADN-121 - 5009141
需要以下其中之一:2 次疫苗接种(疫苗接种可以是 MMR 联合疫苗接种,但如果提交了个性化疫苗接种,则必须提交 2 次腮腺炎疫苗接种、2 次麻疹疫苗接种和 2 次风疹疫苗接种。)或所有 3 种成分的阳性抗体滴度(需要实验室报告,最好是数字和参考范围)。如果您的系列正在进行中,请提交您在系列中的当前位置,系统将为您创建新的警报以完成系列或滴度。如果滴度为阴性或不明确,您必须提交重复系列(1 次 MMR 可以随时接种,1 次 MMR 必须在滴度接种后接种)或您必须提交加强针和重复滴度。学生须知:MMR 疫苗应按照以下时间表接种:疫苗 1:出生或任何时候疫苗 2:疫苗接种后至少 1 个月 1 专业执照
CPT 助理指南:猴痘;2022 年 7 月
为应对猴痘引起的公共卫生问题的紧急性质,现行程序术语 (CPT ® ) 编辑小组 (以下简称“小组”) 批准了三个针对猴痘的新代码。小组批准了一个代码 (87593) 用于报告正痘病毒的实验室诊断检测,并批准了两个新的疫苗产品代码 (90611、90622),分别用于天花和猴痘联合疫苗 (JYNNEOS) 和传统天花疫苗 (ACAM2000)。AMA 已加快将这些新代码发布到 AMA 网站 https://www.ama-assn.org/practice-management/cpt/orthopoxvirus-and-monkeypox-coding-guidance 。这些代码立即生效,可用于报告正痘病毒的实验室检测和使用这些疫苗产品的疫苗接种。请注意,这些代码未出现在 CPT 2022 代码集中;但是,它们将分别包含在病理学和实验室部分的微生物学子部分和医学部分的疫苗、类毒素子部分中的 CPT 2023 代码集中。
疫苗接种准备保证计划 3.0
上线模拟 37 持续质量保证 38 附录 1 – 准备情况和保证文件表 39 附录 2 – 澳大利亚政府联合疫苗接种点要求和声明表 V6 40 附录 3 - COVID-19 入职和保证手册 41 附录 4 – 途径三:针对经昆士兰卫生部批准并与昆士兰政府合作的疫苗服务提供商 42 附录 5 – 自我保证清单 43 附录 6 – 5 至 11 岁儿童临床保证指南 46 附录 7 – COVID-19 场地许可协议模板 47 附录 8 – 大型社区疫苗接种地点批准清单 48 附录 9 – 疫苗接种地点可访问性清单 49 附录 10 – QCVMS 批准/不批准清单 50 附录 11 – QCVMS 豁免模板请求 57 附录 12 – QG-CS 提供商状态批准模板 62
COVID-19 疫苗接种计划
并借鉴 2009 年 H1N1 疫苗接种运动、季节性流感运动和其他应对措施的改进,以确定准备不足。2020 年 8 月初,科罗拉多州公共卫生和环境部 (CDPHE) 在科罗拉多州公共安全部 (CDPS) 的支持下,召集了一个多机构、多部门团队,专注于实施 COVID-19 疫苗的接收和分发。来自州长办公室、公共卫生、各州机构、临床协会、大学、药房、医院系统和社区组织的 20 多个组织参与其中。联合疫苗规划小组由指导委员会领导,分为五个工作线 (LOE),重点关注规划的各个方面,包括免疫分发和数据管理、关键人群、健康公平、公共信息和后果管理。联合疫苗规划小组是应对 COVID-19 大流行的整体联合事件指挥结构的一部分。从高层次来看,科罗拉多州免疫信息系统 (CIIS)、科罗拉多州免疫登记处以及我们在儿童疫苗 (VFC) 计划方面的经验将成为管理与分配、订购、分发、重新分配、库存管理、管理文档、安全监控、第二剂提醒和报告相关的流程和数据的支柱。供应商注册将使用 CDC 的供应商注册协议,通过科罗拉多州公共卫生报告系统 (CoPHR) 以电子方式处理。随着 COVID-19 疫苗被分配到科罗拉多州,CDPHE 将与当地公共卫生机构 (LPHA) 合作,根据科罗拉多州所处的 COVID 疫苗分配阶段、有资格接种 COVID-19 疫苗并可以为优先人群接种疫苗的供应商、当前的 COVID-19 阳性率和传播率以及其他当地考虑因素,确定疫苗应在其管辖范围内的分配地点。公共信息和合作伙伴沟通将由联合指挥部联合信息中心 (JIC) 处理,CDPHE 将在年底前启动全州范围的 COVID 疫苗媒体宣传活动。为了确保公平、透明且公正的分配制度符合道德规范,CDPHE 还通过州长专家紧急流行病应对委员会 (GEEERC) 征求了更多医疗专家的意见,该委员会在出现或持续的公共卫生威胁期间为州长提供建议。GEEERC 成立了一个小组委员会,即医疗咨询小组 (GMAG),为 COVID-19 疫苗分配的初步分阶段方法提供建议,该方法与国家科学、工程和医学院 (NASEM) 框架非常一致,同时仍考虑到科罗拉多州的具体考虑因素。当疫苗不足以为某一阶段的所有人接种时,GMAG 建议为阶段内优先排序提供了更详细的指导。GMAG 与关键人群 LOE 密切合作,统计了每个阶段的人口,直至县级。科罗拉多州的分配指导可能会根据免疫实践咨询委员会 (ACIP) 的正式指导而发生变化。