XiaoMi-AI文件搜索系统
World File Search System义隆电子股份有限公司章程
实收资本额时不在此限;另视公司营运需要及法令规定提列特别盈余公积,如尚有盈余并同期初未分配盈余,由董事会拟具盈余分配案,以发行新股方式为之时,应提请股东会决议后分派之。 本公司依公司法规定,授权董事会以三分之二以上董事之出席,及出席董事过半数之决议后,将应分派股息及红利或公司法第二百四十一条第一项规定之法定盈余公积及资本公积之全部或一部以发放现金之方式为之,并报告股东会。股利分派比例如下: 当年度拟分派盈余数额不得低于累积可分配盈余之百分之五十;现金股利,不得低于股利总额之百分之十。 员工酬劳发给股票或现金之对象,得包括符合一定条件之控制或从属公司员工。 第七章附则第三十条:本公司组织规程及办事细则另定之。 第三十一条:本章程未订事项,悉依公司法及其他法令规章办理。
北京Saimo Technology Co.,Ltd。北京赛目科技股份有限...
此公告不用于在美国(包括其领土和财产,美国和哥伦比亚特区的任何领土和财产)发行,直接或间接发行,直接或间接发行。本公告不构成或构成任何要约或征集的一部分,以购买或订阅美国或其他任何司法管辖区。根据1933年的《美国证券法》(不时修订)(“美国证券法”)或美国的任何州或其他管辖权的证券法(“美国证券法”(《美国证券法》)或证券法,不得在美国或不得在美国内部或为美国企业中的earlational(或福利)(作为earlation of of美国的企业)(作为``法案''的法定(“美国证券法”)(“美国证券法”)或其他委员会(作为earvation of of美国)(作为“法”定义, ”)除交易中免于或不符合《美国证券法》的注册要求。根据法规S,将在美国在离岸交易境外提供和出售要约股份。
半导体晶圆传输解决方案
Mar 11, 2024 — 沉阳新松半导体设备有限公司成立于2023年,是一家专注于半导体晶圆传输专用设备的研. 发、生产、销售与技术服务的高新技术企业。公司前身为新松机器人自动化股份有限 ...
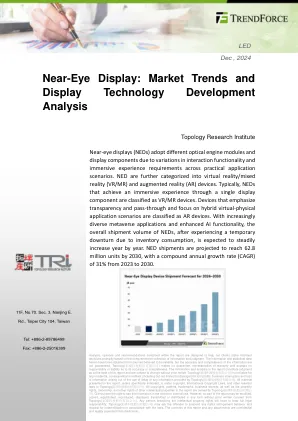
近眼显示:市场趋势和展示技术...
报告中包含的分析,意见和建议旨在帮助我们的客户根据信息和判断的全面收集来立即做出明智的决定。本文的信息和统计数据是从认为是可靠的来源获得的,但是不能保证信息的准确性和完整性。拓扑(togology(拓墣科技股份有限公司)不保证保修,保修,并且对其准确性或完整性不承担任何责任。报告中的信息和分析构成本报告日期的判断,并在未经事先通知的情况下进行更改。拓扑(拓墣科技股份有限公司)对损失的利润损失,业务中断和信息损失的任何偶然,间接或不限于)不承担任何责任。报告中提出的所有材料(除非明确指出)属于版权,国际版权法和拓扑的其他相关法律(拓墣科技股份有限公司)。所有版权,专利,商标,商业秘密以及报告中其他知识产权的财产权,所有权和其他权利均由拓扑(拓墣科技股份有限公拓墣科技股份有限公)拥有。客户有权使用报告中的信息供内部使用。但是,未经拓扑(拓墣科技股份有限公司)的事先书面同意,以任何形式的任何形式都不能修改,复制,重新复制,显示,传输,传输,传输,传输,传输或分发。本报告的内容和任何附件都是机密的,并受到法律保护。任何违反知识产权的人都必须承担全部法律责任;拓扑(拓墣科技股份有限公司)可以要求罪犯暂停任何权利侵权行为,并根据法律要求赔偿。
EV牵引逆变器的开发和预测...
报告中包含的分析,意见和建议旨在帮助我们的客户根据信息和判断的全面收集来立即做出明智的决定。本文的信息和统计数据是从认为是可靠的来源获得的,但是不能保证信息的准确性和完整性。拓扑(togology(拓墣科技股份有限公司)不保证保修,保修,并且对其准确性或完整性不承担任何责任。报告中的信息和分析构成本报告日期的判断,并在未经事先通知的情况下进行更改。拓扑(拓墣科技股份有限公司)对损失的利润损失,业务中断和信息损失的任何偶然,间接或不限于)不承担任何责任。报告中提出的所有材料(除非明确指出)属于版权,国际版权法和拓扑的其他相关法律(拓墣科技股份有限公司)。所有版权,专利,商标,商业秘密以及报告中其他知识产权的财产权,所有权和其他权利均由拓扑(拓墣科技股份有限公拓墣科技股份有限公)拥有。客户有权使用报告中的信息供内部使用。但是,未经拓扑(拓墣科技股份有限公司)的事先书面同意,以任何形式的任何形式都不能修改,复制,重新复制,显示,传输,传输,传输,传输,传输或分发。本报告的内容和任何附件都是机密的,并受到法律保护。任何违反知识产权的人都必须承担全部法律责任;拓扑(拓墣科技股份有限公司)可以要求罪犯暂停任何权利侵权行为,并根据法律要求赔偿。
...飞机事故调查组
此次严重事故征候调查依据《2017 年民航法》、1984 年 CAR 第 13 部分以及《芝加哥国际民用航空公约》附件 13 进行。根据 2016 年 6 月 22 日的办公室命令 CAAB/CS/32/AAIG- BD/01/MASTER,调查权委托给孟加拉国航空事故调查组负责人(AAIG-BD)。泰国国际航空股份有限公司企业航空安全、安保和标准副总裁通过电子邮件向 AAIG-BD 负责人发送了一份强制性事故报告(MOR),报告叙述了 2018 年 7 月 24 日 TG 321 航班(BKK-DAC)在孟加拉国达卡哈兹拉特沙贾拉勒国际机场(VGHS)降落时发生的跑道偏离事件,事故涉及一架波音 777-200 飞机,注册号为 HS-TJD。报告显示,机上有 2 名飞行机组人员和 13 名客舱机组人员以及 1 名地面工程师,机上有 14 名商务舱乘客和 141 名经济舱乘客。报告进一步指出,飞机有 6 个轮胎爆胎。事故发生后,AAIG-BD 负责人立即成立了一个由四 (04) 名调查员组成的航空事故调查小组 (AAIT),其中 AAIG-BD 负责人本人是 IIC,负责开展必要的调查。该事件的初步调查报告于 2018 年 8 月 23 日发布,并根据标准发送给所有相关国家和组织
中兴通讯股份有限公司关于仁兴科技收购中兴微电子24%股权暨公司放弃优先认购权的公告
本公司及董事会全体成员保证本信息披露内容真实、准确、完整,本公告不存在任何虚假、误导性陈述或者重大遗漏。 特别提示: 本次收购已经本公司董事会审议通过,尚需中兴通讯股东大会批准及财政部评估备案,若截至2020年9月30日(含当日),本次收购仍未获得中兴通讯股东大会批准或仍未完成财政部评估备案程序,则除非交易双方另行协商达成补充协议或新的交易文件,本次收购将自动失效。本公司将根据交易进展情况及时履行信息披露义务。请投资者注意。经国家集成电路产业投资基金股份有限公司(“集成电路基金”)与中兴通讯股份有限公司(“公司”或“中兴通讯”)友好协商,公司拟通过全资子公司深圳市仁兴科技有限责任公司(“仁兴科技”)收购深圳市中兴微电子技术有限公司24%股权。中兴微电子有限公司(“中兴微电子”),为本公司之子公司,由集成电路基金持有(“收购”)。就仁兴科技收购中兴微电子股权而言,本公司及本公司下属合伙企业深圳市赛佳讯投资发展企业(有限合伙)(以下简称“赛佳讯”)将放弃就本次收购各自享有的优先认购权。本次收购已经本公司第八届董事会第二十三次会议审议通过。根据中兴通讯股份有限公司章程的有关规定,本次收购尚需股东大会批准。本次收购不构成深圳证券交易所股票上市规则项下的关联交易或《上市公司重大资产重组管理办法》项下的重大资产重组。收购事项并不构成本公司根据第14A章所订的关连交易或本公司根据第14章所订的须予披露交易
孟加拉国飞机事故调查组 (AAIG-BD)
本次严重事故调查依据《2017 年民航法》、《1984 年中国民航公约》第 13 部分以及《芝加哥国际民用航空公约》附件 13 进行。调查权已授予孟加拉国航空事故调查组负责人 (AAIG-BD),具体授权号为 CAAB/CS/32/AAIG- BD/01/MASTER,日期为 2016 年 6 月 22 日。AAIG-BD 负责人通过电子邮件收到了一份强制性事件报告 (MOR),该报告由泰国国际航空股份有限公司企业航空安全、安保和标准副总裁发送,内容涉及 2018 年 7 月 24 日 TG 321 航班 (BKK-DAC) 在孟加拉国达卡哈兹拉特沙贾拉勒国际机场 (VGHS) 降落时发生的跑道偏离,该航班涉及一架波音 777-200 飞机,注册号为 HS-TJD。报告显示,机上有 2 名飞行机组人员和 13 名客舱机组人员以及 1 名地面工程师,机上有 14 名商务舱乘客和 141 名经济舱乘客。报告进一步指出,飞机有 6 个轮胎爆胎。事故发生后,AAIG-BD 负责人立即成立了一个由四 (04) 名调查员组成的航空事故调查组 (AAIT),其中 AAIG-BD 负责人本人是 IIC,负责开展必要的调查。该事故的初步调查报告于 2018 年 8 月 23 日发布,并根据附件 13 的标准 7.1 发送给所有相关国家和组织,并自 2018 年 8 月 23 日起在 CAAB 网站 (www.caab.portal.gov.bd/) 上公布,供公众参考。此次活动的目的不是追究责任或追究责任。已编制关于此事件的最终报告草案,并于 2018 年 12 月 2 日根据国际民航组织附件 13 和孟加拉国航空事故调查组 (AAIG-BD) 汇编发送给不同国家和行政部门/组织征求意见。已纳入来自各个国家和组织的评论,以重组此最终报告。此次调查的唯一目的是防止航空事故和事件。本报告中包含的信息来自对事件进行持续调查期间收集的事实信息和证据。