XiaoMi-AI文件搜索系统
World File Search System胆囊癌的耐药性和新疗法
胆囊癌(GBC)是一种高度侵略性的恶性肿瘤,对及时诊断提出了重大挑战,导致预后惨淡。在手术不可行的情况下,化学疗法是主要治疗选择。然而,化学抗性的出现对化学疗法的有效性构成了重大挑战,最终导致预后不良。尽管对肿瘤学中化学治疗性的机制进行了广泛的研究,但GBC中化学耐药性的潜在机制仍然很少了解。在这篇综述中,我们介绍了过去十年中关于GBC化学疗法抗性的分子机制的发现。我们希望这些见解可以提供新颖的治疗和实验靶标,以进一步研究这种致命疾病。
胆管癌和胆囊癌(胆道)
完整的诊断检查可为多学科团队提供必要信息,以便确定胆道癌患者并为其提供最佳治疗。多学科团队应由放射科医生、普通外科医生和肝胆外科医生、胃肠病学家和肝病学家以及肿瘤学家组成。诊断检查应评估肝脏的局部和血管扩散/侵袭情况。无法切除或转移性疾病代表无法治愈的情况,应考虑姑息治疗。腹部超声检查可确认胆管扩张、定位阻塞部位并排除胆结石。三相 CT 扫描可检测疾病、确定胆道阻塞水平并识别任何区域淋巴结肿大或转移性疾病。近端胆管癌和胆囊癌:为确定可切除性,诊断检查应确定肝脏两叶肿瘤的近端范围。这可以通过磁共振胰胆管造影 (MRCP) 来实现,但可能需要经皮经肝胆管造影 (PTC)。患者在手术评估之前不应接受经皮活检。对于近端肿瘤,磁共振胰胆管造影比内镜逆行胰胆管造影 (ERCP) 更受欢迎,因为其脓毒症并发症风险较低。如果不能进行 MRCP
胆囊癌的耐药性和新疗法
胆囊癌(GBC)是一种高度侵略性的恶性肿瘤,对及时诊断提出了重大挑战,导致预后惨淡。在手术不可行的情况下,化学疗法是主要治疗选择。然而,化学抗性的出现对化学疗法的有效性构成了重大挑战,最终导致预后不良。尽管对肿瘤学中化学治疗性的机制进行了广泛的研究,但GBC中化学耐药性的潜在机制仍然很少了解。在这篇综述中,我们介绍了过去十年中关于GBC化学疗法抗性的分子机制的发现。我们希望这些见解可以提供新颖的治疗和实验靶标,以进一步研究这种致命疾病。
胆囊癌的靶向治疗
因其他原因行胆囊切除术。病例组中,24 例患者(12.8%)有显著的 HER2/neu 过表达(免疫组化定义为 3+)。相反,没有阳性病例。HER2 过表达在分化良好的 GC(17.4%)和晚期患者(13.8%)中相对更常见 [ 28 ]。HER2/neu 过表达的患者预后较差,5 年 OS 为 34% 对比 GC 阴性患者的 41%。虽然这种差异在统计学上并不显著,但它反映了其他恶性肿瘤的类似数据,其中与 HER2/neu 过表达相关的肿瘤特别具有侵袭性 [ 29 ]。作者确定了 HER2/neu 过表达的 GC 患者亚组可能受益于特定的分子靶向治疗。文献中的其他类似系列证实了这些数据[30–32]。
胆囊癌当前靶向治疗概述
胆囊癌 (GBC) 罕见,但却是胆道肿瘤中恶性程度最高的一种。不幸的是,只有一小部分癌症患者可以接受手术切除,这是目前有效的治疗方案;因此,数十年来,该病的高死亡率一直保持不变。为了从根本上避免这种停滞不前的局面,由于先进技术措施(例如,下一代测序、转录组学、蛋白质组学)的出现,许多治疗方法得到了大力创新,其中包括靶向治疗、免疫治疗和基于纳米颗粒的递送系统。在当前的综述中,我们主要关注能够特异性抑制控制 GBC 中异常信号级联的单个关键分子的靶向治疗。GBC 靶向治疗的全球临床试验已更新,可能为这种致命疾病的新病理学和治疗见解提供巨大价值,最终提高治疗效果。
胆囊癌中的微生物组营养不良:全身评论
胆囊癌(GBC)始于上皮组织(胆管和胆囊的衬里)。这是一种称为腺癌的侵袭性癌症,可以扩散到其他组织。在所有胆道癌病例中,有50%来自GBC。这是一种致命的癌症,在2007年至2013年期间的存活率为17.6%。GBC在西方世界很少发现,但在南亚通常可以找到。在东南亚国家,GBC在与癌症有关的发病率和死亡率中起着重要作用。 GBC的发病率显示出明显的区域可变性,在西方人口中是罕见的状况,但在印度的频率较高,尤其是印度 - 抗议带和一些不包括那加兰邦的东北地区。 这可能归因于环境因素和遗传易感性调节癌变的差异。 在GBC中,在早期阶段仅确定10%的病例。 较低的早期检测率是由于缺乏筛查技术和肿瘤的攻击性特征所致。 各种危险因素与GBC有关,例如,有或没有胆结石的慢性胆囊炎,肥胖症,暴露于铅和砷,细菌感染,先天性胆道囊肿和胰腺异常的胰腺造成肌管连接。 危险因素可能导致慢性胆囊粘膜刺激,导致发育不良和肿瘤。 GBC可以在5 - 15年的时间内形成转移性异常,然后在原位进行癌,最后是侵入性癌症。 营养不良导致包括癌症在内的各种疾病。在东南亚国家,GBC在与癌症有关的发病率和死亡率中起着重要作用。GBC的发病率显示出明显的区域可变性,在西方人口中是罕见的状况,但在印度的频率较高,尤其是印度 - 抗议带和一些不包括那加兰邦的东北地区。这可能归因于环境因素和遗传易感性调节癌变的差异。在GBC中,在早期阶段仅确定10%的病例。较低的早期检测率是由于缺乏筛查技术和肿瘤的攻击性特征所致。各种危险因素与GBC有关,例如,有或没有胆结石的慢性胆囊炎,肥胖症,暴露于铅和砷,细菌感染,先天性胆道囊肿和胰腺异常的胰腺造成肌管连接。危险因素可能导致慢性胆囊粘膜刺激,导致发育不良和肿瘤。GBC可以在5 - 15年的时间内形成转移性异常,然后在原位进行癌,最后是侵入性癌症。营养不良导致包括癌症在内的各种疾病。多个触发因素会引起营养不良,例如环境变化,炎症,感染,药物,饮食变化或遗传易感性。各种研究表明,幽门螺杆菌,人乳头瘤病毒,丙型肝炎病毒和丙型肝炎病毒微生物物种会引起癌症。它们是负责90%与感染相关癌症的主要物种。各种研究表明,沙门氏菌和螺旋杆菌的菌株与发展GBC有关。虽然将肠道菌群与GBC联系起来的机制尚不完全了解,但一些研究表明潜在的关联。根据一项研究,与邻近的正常组织相比,某些肠道微生物组(例如核细菌)在GBC组织中发现了GLUT。通过评估肠道微生物组营养不良,我们可以看到肠道微生物组失调与GBC之间的潜在联系;它可以为GBC的发展和发展提供宝贵的见解。这可能导致鉴定新的诊断标记和新型治疗策略的发展。在GBC中,肠道微生物组营养不良的评估(涉及患者肠道微生物组的组成,多样性和功能能力)已成为一种有前途的方法,用于了解分子机制,并鉴定出早期预防和检测GBC的生物标志物,并在GBC之间进行任何疾病,并研究了任何链接之间的响应范围和距离guti的可能性。总而言之,在GBC中评估肠道微生物组营养不良是确定潜在的早期检测和预防生物标志物的有前途的方向。因此需要进行其他研究,以确定肠道微生物组营养不良在GBC的发展和进展中的作用,并确定可靠的生物标志物以供临床使用。
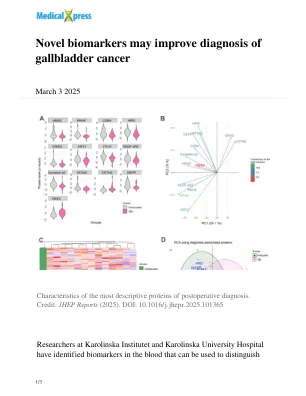
新型生物标志物可能会改善胆囊癌的诊断
研究人员分析了Karolinska大学医院的82例患者的血液样本,患有胆囊癌。他们使用了机器学习和蛋白质组学 - 蛋白质结构和功能的最大尺度分析,以识别潜在的生物标志物。通过检查7,500种不同的蛋白质,研究人员能够鉴定651种蛋白质,这些蛋白质取决于患者是否患有癌症或炎症。,八种蛋白质表现出特别高的诊断准确性。,八种蛋白质表现出特别高的诊断准确性。
整合基因组学凸显了针对胆囊癌肿瘤微环境的创新疗法的机会
Stephanie Roessler、Julien Edeline、Peter Schirmacher、Cédric Coulouarn。整合基因组学强调了针对胆囊癌肿瘤微环境的创新疗法的机会。《肝脏病学杂志》,2021 年,74 (5),第 1018-1020 页。�10.1016/j.jhep.2020.12.024�。�hal-03156698�
建立并鉴定患者来源的原代细胞系作为胆囊癌临床前模型
胆囊癌(GBC)是最常见的原发性胆道癌(BTC),是致死率最高的恶性肿瘤之一,来源于胆囊或胆囊管。GBC占BTC的近三分之二,是第六大常见胃肠道癌症(1),具有生长迅速、致死率高的特点。在中国,GBC是第五大胃肠道癌症,高发年龄为50~75岁,女性发病率约为男性的2倍(2,3)。GBC起病隐匿,早期诊断困难,恶性程度高,易发生早期转移,因此GBC预后极差,大多数患者初次诊断时已属晚期,晚期GBC的5年生存率为5%~10%(4)。
IVb 期不可切除胆囊的转化治疗……
胆囊癌是消化系统高度恶性肿瘤,IVb期胆囊癌5年生存率仅为2%(1)。对于无法切除的胆囊癌,虽然2019年美国国立综合癌症网络(NCCN)发布的指南推荐放疗联合化疗作为一线治疗,但尚未见良好预后的报道(2)。转化疗法是指对部分晚期癌症患者,在全身治疗有效的前提下,通过根治性手术获得长期生存(3,4)。本文报道了1例61岁男性IVb期胆囊癌患者,诊断为腹部、腹膜后、纵隔及双侧肺门多发淋巴结转移。随访结果显示,患者转化疗法后无病生存期(DFS)为11.3个月,总生存期(OS)为18.1个月。