XiaoMi-AI文件搜索系统
World File Search SystemJennifer Jager博士Jennifer Jager博士
2018年至今:研究人员CRCN Inserm(任期职位)。地中海分子医学中心(C3M),科特德大学,尼斯法国。团队:肥胖症和2型糖尿病的胰岛素抵抗。导演:Tanti博士和Cormont博士。2017-18:助理教授。 Myriam Aouadi博士的实验室,瑞典Karolinska Institutet的综合有氧代谢中心。 标题:肝巨噬细胞在肥胖诱导的胰岛素抵抗中表达的微RNA的作用。 2015-2017:高级博士学位研究员。 Myriam Aouadi博士的实验室,瑞典Karolinska Institutet的综合有氧代谢中心。 项目:肝巨噬细胞在肥胖诱导的胰岛素抵抗中的作用。 2010-2015:博士后研究员。 美国费城宾夕法尼亚大学米切尔·拉扎尔博士的实验室。 标题:核受体REV-ERBα在昼夜节律和代谢中的作用。 2009:博士学位。 《生命科学》,法国尼斯·苏皮亚·安蒂波利大学。 主管:J.F.博士 tanti。 标题:ERK途径在肥胖症中脂肪组织炎症和胰岛素抵抗的影响。 2005:尼斯索菲亚·安蒂波利斯大学的分子和细胞生物学和生理学高级研究硕士。2017-18:助理教授。Myriam Aouadi博士的实验室,瑞典Karolinska Institutet的综合有氧代谢中心。标题:肝巨噬细胞在肥胖诱导的胰岛素抵抗中表达的微RNA的作用。2015-2017:高级博士学位研究员。Myriam Aouadi博士的实验室,瑞典Karolinska Institutet的综合有氧代谢中心。项目:肝巨噬细胞在肥胖诱导的胰岛素抵抗中的作用。2010-2015:博士后研究员。美国费城宾夕法尼亚大学米切尔·拉扎尔博士的实验室。标题:核受体REV-ERBα在昼夜节律和代谢中的作用。2009:博士学位。 《生命科学》,法国尼斯·苏皮亚·安蒂波利大学。 主管:J.F.博士 tanti。 标题:ERK途径在肥胖症中脂肪组织炎症和胰岛素抵抗的影响。 2005:尼斯索菲亚·安蒂波利斯大学的分子和细胞生物学和生理学高级研究硕士。2009:博士学位。《生命科学》,法国尼斯·苏皮亚·安蒂波利大学。主管:J.F.博士tanti。标题:ERK途径在肥胖症中脂肪组织炎症和胰岛素抵抗的影响。2005:尼斯索菲亚·安蒂波利斯大学的分子和细胞生物学和生理学高级研究硕士。
肥胖和 2 型糖尿病博士后奖学金
肥胖、超重和 2 型糖尿病 (T2D) 是主要的公共卫生问题。脂肪组织将多余的能量储存为脂肪,并充当内分泌器官,释放影响新陈代谢、食欲和胰岛素敏感性的激素和炎症分子。我们的研究特别关注与肥胖/糖尿病有关的 G 蛋白偶联受体 (GPCR) 的功能。GPCR 具有重要的治疗意义,因为它们很容易被药物靶向。我们正在寻找一位积极主动且才华横溢的博士后研究员加入一个资助项目,旨在通过体外和体内实验揭示 GPCR 在肥胖和糖尿病中的作用(PI:Julie DAM 博士)。
II型糖尿病协议
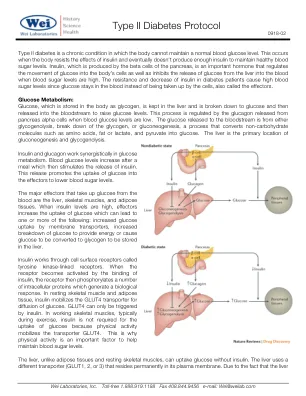
II型糖尿病方案II型糖尿病是一种慢性病,人体无法维持正常的血糖水平。当人体抵抗胰岛素的作用并且最终无法产生足够的胰岛素以维持健康的血糖水平时,就会发生这种情况。胰岛素是由胰腺的β细胞产生的,是一种重要的激素,可调节葡萄糖进入人体细胞,并在血糖水平高时抑制葡萄糖从肝脏中释放到血液中。糖尿病患者的胰岛素耐药性和降低会导致高血糖水平,因为葡萄糖停留在血液中,而不是被细胞吸收,也称为效应子。葡萄糖代谢:葡萄糖作为糖原存储在体内,保存在肝脏中,并分解为葡萄糖,然后释放到血液中以提高葡萄糖水平。当血糖水平较低时,该过程受到胰腺细胞释放的胰高血糖素的调节。释放到血液的葡萄糖来自糖原分解,分解糖原或糖生成,这一过程转化了非碳水化合物分子(例如氨基酸,脂肪或乳酸),并丙酮酸酸盐。肝脏是糖异生和糖原分解的主要位置。胰岛素和胰高血糖素在葡萄糖代谢中协同起作用。餐后血糖水平升高,然后刺激胰岛素的释放。此释放促进了葡萄糖对效应子降低血糖水平的摄取。胰岛素通过称为酪氨酸激酶连接受体的细胞表面受体起作用。从血液中吸收葡萄糖的主要效应子是肝脏,骨骼肌和脂肪组织。当胰岛素水平较高时,效应子会增加葡萄糖的摄取,这可能导致以下一项或多种:膜转运蛋白的葡萄糖吸收增加,增加葡萄糖的分解以提供能量或导致葡萄糖转化为糖原,以存储在肝脏中。当受体被胰岛素的结合激活时,受体会磷酸化许多产生生物学反应的细胞内蛋白。在静止的骨骼肌和脂肪组织中,胰岛素动员GLUT4转运蛋白以扩散葡萄糖。GLUT4只能由胰岛素触发。在工作骨骼肌中,通常在运动过程中,胰岛素不需要摄取葡萄糖,因为体育活动动员了转运蛋白的GLUT4。这就是为什么体育活动是帮助维持血糖水平的重要因素的原因。与脂肪组织和静止的骨骼肌不同,肝脏可以摄取无胰岛素的葡萄糖。肝脏使用不同的转运蛋白(Glut1、2或3),该转运蛋白驻留在其质膜中。由于肝脏
预订,可以选择RYC2022
Área Temática: Biociencias y biotecnología Nombre: PEYROU , MARION Referencia: RYC2022-037961-I Correo Electrónico: peyrou.marion@gmail.com Título: From brown adipose tissue to hepatic function Resumen de la Memoria: I obtained my Ph.D. 2013年在日内瓦大学生物学博士学位,该大学的非酒精性脂肪肝疾病(NAFLD)的世界专家Foti教授。我研究了肿瘤抑制剂PTEN在人类肝炎病毒改变的分子机制中的作用,并导致肝代谢缺陷,例如脂肪变性和肝细胞癌(HCC)。这项研究导致了两家出版物作为肝病学和肝病学杂志的第一作者,并通过两个奖品的归因而进一步认可。在我在FOTI实验室中担任博士后研究员的去年,我调查了肝抑制PTEN对外围器官葡萄糖和脂质代谢的影响。i表明,肝细胞中的PTEN缺乏症会触发肝脏至外交器官串扰,从而降低肥胖性和提高肌肉胰岛素敏感性。作为第一作者的研究结果已于2015年发表在《肝病学杂志》上。然后,我选择将下一个研究集中在与肥胖和II型糖尿病相关的代谢疾病上。2014年,我在巴塞罗那大学的脂肪生物学领域的世界领导者Villarroya教授的实验室开始了博士后住宿,调查了与棕色脂肪组织与外围器官传播有关的分子机制,其中包括叶子。因此,我的工作在脂肪细胞生物学和肝物理病理学之间一直保持联系。我们的发现确定了Kininogen系统是BAT热调节的相关组成部分,该组件为BAT提供自动调节性抑制性信号传导。作为第一作者的这项研究已于2020年发表在《自然通信》上。我们还表明,血管周围脂肪组织库中米色表型的获取与可能针对血管系统的双向基因的上调有关。我在2021年在生理学边界发表了这项研究。此外,我为Villarroya实验室的不同项目做出了贡献,涉及发现由BAT分泌的新的Batokines并影响外围细胞。这些合作产生了7个出版物(包括NAT通讯和一个单元格代表)和4个评论。值得一提的是,我在2016年和2020/2021年有2个产妇叶子,每个产妇有6个月。总而言之,我的专业知识领域涉及肝脏病理学以及棕色脂肪组织生物学,从而结合了两个不同的专业领域。在我职业生涯的这个阶段,我认为自己准备在研究发展方面发挥领导作用,我感到完全准备成功进行。
工作优惠:博士后职位 - 巴黎
肥胖,超重和2型糖尿病(T2D)是主要的公共卫生问题。脂肪组织将多余的能量作为脂肪存储,并充当内分泌器官,释放影响代谢,食欲和胰岛素敏感性的激素和炎性分子。我们的研究专门关注与肥胖/糖尿病有关的G蛋白偶联受体(GPCR)的功能。GPCR具有重大的治疗兴趣,因为它们很容易被药物瞄准。我们正在寻求一名有动力且才华横溢的博士后研究人员加入一个资助的项目,旨在使用蜂窝和体内实验(PI:Julie Dam博士),旨在揭示GPCR在肥胖和糖尿病中的作用。
脂肪授予的干细胞:组织工程中的血管生成潜力和效用
摘要:脂肪组织(AT)是一个大而重要的储能器官,并且是在许多过程中具有关键作用的内分泌器官。此外,AT是当今用于所有类型的组织再生的巨大且易于获取的多能细胞类型的来源。在组织工程中使用脂肪衍生的干细胞(ADSC)分化为其他类型的细胞,例如内皮细胞(ECS),血管平滑肌细胞或心肌细胞,以促进/刺激血管生成过程。作为未来成功临床应用的关键,工程组织中的功能性血管网络是许多体内和实体研究的目标。本文回顾了ADSC的血管生成潜力,并探讨了它们在组织工程领域(TE)的能力。
用于骨科应用的干细胞和细胞骨基质产物
• AmnioFix® (MiMedx) • Bio4™ Viable Bone Matrix (formely known as Ovation®) (Osiris Therapeutics/Stryker) • Bone marrow aspirate • Cellentra™ VCBM (Viable Cell Bone Matrix) (ZimVie) • CeLLogix™ (Omnia Medical) • Clarix® Cord 1K (BioTissue) • FiberCel® (Aziyo Biologics)•脂质®微碎片脂肪组织移植系统•Magnus®骨移植(皇家生物学)•MAP3®(RTI手术)•Osteocel®Plusand Pro and Pro and Pro(nuvasive) Primagem®高级同种异体移植(Zimmer Biomet)•RegeNEXX(再生科学)•Scylla™和Scylla™-F(室脊柱)•TrinityEvolution®和Elite®(Orthofix Inc. (Depuy合成)。
预测意义
糖尿病是全球性的公共卫生问题,发病率和死亡率逐年上升(1),但早期干预可有效延缓和减少高危人群患糖尿病的机会(2-5),而要实现这一目标,及早识别和发现糖尿病高危人群至关重要(6,7)。既往研究表明,糖尿病的患病率和进展存在明显的性别差异(8,9),且这种差异随时间而变化(10,11)。因此,在精准医疗的新时代,量化男女未来糖尿病风险,评估高危人群趋势,为基层医生提供针对性别的干预措施参考,从而降低糖尿病的发病率,刻不容缓。当前,糖尿病正处于迅速蔓延的流行病之中,多数论据支持糖尿病蔓延趋势主要归因于肥胖症的流行(12,13)。肥胖主要表现为皮下脂肪组织 (SAT) 和内脏脂肪 (VAT) 的堆积 (14,15)。然而,越来越多的证据表明,异位沉积的脂肪组织 VAT 与胰岛素抵抗的关联性比 SAT 更强,并且在糖尿病的发展中起着更重要的作用 (16-18)。此外,微环境中内脏脂肪的性别差异显著影响糖尿病的发展 (19,20)。因此,量化内脏脂肪可能提供一种更有效的方法来评估不同性别人群的糖尿病风险,并准确预测其发病率和未来趋势。然而,精确的内脏脂肪测量需要腹部计算机断层扫描或核磁共振成像扫描,而这些扫描价格昂贵且不易获得 (21),阻碍了它们在大规模人群健康筛查中的应用。因此,开发简单而有效的内脏脂肪评估替代方法势在必行。近年来,Kahn 等人利用腰围 (WC) 和甘油三酯 (TG) 水平计算出的 LAP 已成为评估 VAT 的有效替代方法 ( 22 , 23 )。
CD44 缺失通过调控 PPARγ 和细胞周期相关通路促进脂肪生成
CD44 是一种细胞表面粘附受体和干细胞生物标志物,最近与慢性代谢疾病有关。CD44 的消融可改善肥胖中的脂肪组织炎症和胰岛素抵抗。在这里,我们研究了人类和小鼠脂肪组织中细胞类型特异性 CD44 的表达,并进一步研究了前脂肪细胞中的 CD44 如何调节脂肪细胞功能。使用 Crispr Cas9 介导的基因缺失和慢病毒介导的基因重新表达,我们发现 CD44 的缺失会促进脂肪细胞分化和脂肪生成,而 CD44 的重新表达会消除这种影响并降低 3T3-L1 细胞中的胰岛素反应和脂联素分泌。从机制上讲,CD44 通过抑制 Pparg 表达来实现这一点。通过定量蛋白质组学分析,我们进一步发现细胞周期调节通路大多因 CD44 的缺失而减少。事实上,CD44 的重新表达适度恢复了参与细胞周期所有阶段的蛋白质的表达。这些数据得到了 CD44 缺陷细胞中前脂肪细胞增殖率增加的进一步支持,而 CD44 的重新表达会削弱这种影响。我们的数据表明,CD44 在调节脂肪生成和脂肪细胞功能方面起着至关重要的作用,可能是通过调节 PPARγ 和细胞周期相关通路实现的。这项研究首次提供了证据,表明在前脂肪细胞中表达的 CD44 在调节主要表达 CD44 的免疫细胞之外的脂肪细胞功能方面起着关键作用。因此,针对(前)脂肪细胞中的 CD44 可能为治疗肥胖相关的代谢并发症提供治疗潜力。
CD44 缺失通过调控 PPARγ 和细胞周期相关通路促进脂肪生成
CD44 是一种细胞表面粘附受体和干细胞生物标志物,最近与慢性代谢疾病有关。CD44 的消融可改善肥胖中的脂肪组织炎症和胰岛素抵抗。在这里,我们研究了人类和小鼠脂肪组织中细胞类型特异性 CD44 的表达,并进一步研究了前脂肪细胞中的 CD44 如何调节脂肪细胞功能。使用 Crispr Cas9 介导的基因缺失和慢病毒介导的基因重新表达,我们发现 CD44 的缺失会促进脂肪细胞分化和脂肪生成,而 CD44 的重新表达会消除这种影响并降低 3T3-L1 细胞中的胰岛素反应和脂联素分泌。从机制上讲,CD44 通过抑制 Pparg 表达来实现这一点。通过定量蛋白质组学分析,我们进一步发现细胞周期调节通路大多因 CD44 的缺失而减少。事实上,CD44 的重新表达适度恢复了参与细胞周期所有阶段的蛋白质的表达。这些数据得到了 CD44 缺陷细胞中前脂肪细胞增殖率增加的进一步支持,而 CD44 的重新表达会削弱这种影响。我们的数据表明,CD44 在调节脂肪生成和脂肪细胞功能方面起着至关重要的作用,可能是通过调节 PPARγ 和细胞周期相关通路来实现的。这项研究首次提供了证据,表明在前脂肪细胞中表达的 CD44 在调节主要表达 CD44 的免疫细胞之外的脂肪细胞功能方面起着关键作用。因此,针对(前)脂肪细胞中的 CD44 可能为治疗肥胖相关的代谢并发症提供治疗潜力。