XiaoMi-AI文件搜索系统
World File Search System肿瘤衍生的仿生纳米元素具有免疫逃避能力,可增强低剂量放射疗法
在4T1肿瘤细胞中,CF和RF的溶血跟踪器绿色FM(蓝色)和DIL(红色)共定位。(b)使用ImageJ软件确定的(a)的DIL荧光强度。(c)JC-1(JC-1单体绿色,在不同处理下用于JC-1的荧光图像红色。(d)使用DAPI和-H2AX染色在所示的细胞中使用DAPI和-H2AX染色可视化核凝结和DNA碎片,并显示了代表性的图片。(e)基于每个处理组100个细胞(γ-H2AX焦点/100μm2,n = 3)的分析,确定了γ-H2AX灶的密度。(f)使用用2或6 Gy辐射处理的4T1细胞(n = 3)进行了菌落形成测定。(g)PMSI对细胞内的影响
细胞NAP:一种用于定量相成像中3D细胞分割的快速,准确算法
1引入细胞形状的调节和协调在生物存在的各个阶段都是天然生理的核心。光学成像的最新进展通过揭示了具有先前未想象的细节的细胞特征和过程,从而为这种现象提供了机械见解。1,2,3对这种复杂的生物过程进行准确分析的中心是细胞图像的精确分割。量化细胞形态,例如形状,面积,循环,纵横比等,首先是在给定视野中首先分割细胞。由于其毫无疑问的意义,已经完成了许多工作来标准化该过程。有发达的开源软件套件,尤其是CellProfiler 4和Cellpose,5,以非常准确地执行此类分割任务。最新对CellProfiler的更新包括三维(3D)图像分割的功能,目前是执行此类任务的最广泛使用的工具。但是,由于当前用于生物成像的主力是荧光显微镜,因此所有标准的分割软件均针对荧光图像进行优化和针对分析。然而,非常需要研究活细胞中各种结构的动力学和生理活性。定量相成像(QPI)使用基于激光的干涉法测量光场图像,并迅速作为可行的成像替代方案出现,因为它提供了无标签方式的形态和动力学的客观度量。这个1除了由常规强度的微拷贝技术提供的振幅图像外,QPI还测量了由样品的折射率(RI)分布控制的光相延迟图。由于内源性RI分布与细胞类型的结构和生化特征密切相关,因此可以分析获得的现场图像,以系统地发现图像中编码的细胞类型特异性形态和生物物理指纹。在过去的二十年中,QPI为各种生物学植物提供了重要的见解,从红细胞的膜动力学6到神经元活性7和细胞纳米粒子相互作用,8、9和细胞 - 滴定相互作用。10最近,还表明QPI图像可以使用深度学习技术映射到荧光图像,这是一种概念,即形成图像到图像的翻译。使用QPI和机器学习的组合的污渍(即,特定的荧光团/污渍将在未标记的标本中结合)的预测,11 - 13及其逐渐添加了更多的污渍。的确,具有计算特异性的相成像可以独立地独立地测量核和细胞质的生长,而不会丧失生存力。中述许多应用和其他紧急应用的中心是QPI在依附和流动的细胞种群中QPI的固有能力,在库中测量单细胞体积和质量非破坏性和超敏感性。1进行此类分析的关键步骤是细胞群体层析成像图像的准确分割。由于QPI成像仍然是细胞生物学领域中相对较新的技术,因此分析管道不像荧光图像那样发达。为荧光图像分割而开发的工具箱与QPI图像无法很好地工作,因为荧光对比度比RI对比度更加清晰。同样,在某些分割程序中,染色的核被用作定义各自的细胞质边界的基准标记,因此,这种算法在QPI成像中不能直接实现。这促使研究人员开发了针对QPI图像量身定制的分割算法,但其适用性仅限于迄今为止的二维图像。用于3D QPI细胞分割的最新方法是一种基于OTSU的3D水置算法15(以下称为这项工作中的OTSU阈值算法)。
一个微流体芯片,用于成人的生长和表征...
摘要 - 成年海马神经茎/祖细胞(AHPC),它们是可以自我更新的多功能祖细胞,可以分化为神经元,星形胶质细胞和少突胶质细胞,是一种中枢神经系统(CNS)分子模型,以及3D AHPC NEURASTOR的形成,是ASANPC AHPC AHPC AHPC的形成。在本文中,我们向芯片上培养室内培养了一种新的微流体芯片(NSS-AHPC)。进行细胞固定和免疫染色后,分析了NSS-AHPC的荧光图像。已经发现,包含神经磷类的AHPC仍然很高。细胞增殖和神经元分化,表明NSS-AHPC作为芯片上的体外脑模型的可行性。鉴于其易于使用,低成本和有序的培养室,这种类型的芯片特别适合以有效的方式培养和分析多个体外大脑模型。
在...
光刺激(来自数字微型摩尔设备的2-D灯罩用固态CW激光照明)和两个光子成像仅限于不同的光学Z-Planes,可以通过分别翻译扩散器和主要目标来灵活,独立地调整这些光学Z-plan。 (底部)在光刺激和成像期之间交替(滚动)。每个红色条代表一个多光子成像的单一框架。光刺激和成像期交错。(b)显微镜示意图。dm,二分色镜。dmd,数字微型摩尔设备。i,虹膜膜片。L1-L12,镜头。o,主要目标。PMT,光电倍增管。PS,潜望镜。s,快门。SM,扫描镜子。(c)(顶部)使用可移动扩散器将图案化的光刺激和多光子成像平面解)的例证。以4F镜头配置将扩散器成像成样品中;沿光路的扩散器转换会导致相应的投影平面轴向移动。OFP,客观焦平面。 PSP,光刺激平面。 (d)DMD芯片到CCD摄像头到2P显微镜注册。 我们注册了DMD刺激场(DMD像素尺寸= 2.4 µm,样品 1d)至148OFP,客观焦平面。PSP,光刺激平面。(d)DMD芯片到CCD摄像头到2P显微镜注册。我们注册了DMD刺激场(DMD像素尺寸= 2.4 µm,样品1d)至148(i)两个光子显微照片,分别为10 µm荧光微粒;箭头标记了两个微粒,这是较大的DMD调节投影靶模式(8 microbeads)的一部分,它们被视为受托点; (ii)更大的视野(包括目标微头)的广阔场荧光图像(全场照明); (iii)从2p图像中选择的ROI用于生成DMD-Chip灯罩;这些进一步投影在主要的客观焦平面上,并使用主CCD摄像头(CCD 1)成像; (iv)DMD生成的照片刺激口罩和(II)中10 µm微粒的宽场荧光图像的覆盖层;请注意,荧光仅限于由DMD光刺激掩模靶向的微粒,并具有最小的溢出到相邻(靶)的微粒(请参阅信托标记)。
在什么时机寄生虫攻击并消耗其宿主
图1。NPC的延迟移植可改善势后的长期移植物存活。(a)示意图显示了实验设计。免疫缺陷rag2 - / - 小鼠在1 dpi(急性)或7 dpi(延迟)处局部移植Rfluc表达NPC的局部移植。(b)激光多普勒成像证实中风后脑血流(CBF)减少。(c)中风诱导后2小时对CBF进行定量。(d)代表性的生物发光成像(BLI)说明了两组选定时间点的6周内NPC存活。(e)两组移植后的前3天内对BLI信号的定量。(g)在移植后7天使用EDU掺入的增生评估的示意性时间表,在42天(急性)和35天(延迟)移植后移植时进行染色,以跟踪移植物增殖。(h)在移植后7天,在35 dpi(延迟)和42 dpi(急性)天以35 dpi(延迟)和42 dpi(急性)天的7天和KI67 + NPC对EDU + NPC进行定量的代表性免疫荧光图像。(j)显示具有多能标记Nanog,NPC标记PAX6,Neuronal标记NEUN和星形胶质细胞标记GFAP的表型面板。(k)移植后六周移植的NPC(HUNU+)的代表性免疫荧光图像。比例尺:50µm。(l)急性移植组中移植物组成的定量。数据显示为平均分布,其中红点表示平均值。框图表示数据的25%至75%四分位数。总共使用了8只动物,每组4只动物。箱形图:图中的每个点代表一种动物。线图被绘制为平均值±SEM。使用未配对的Mann-Whitney U检验(C和E)或未配对的t检验(I)评估平均差异的显着性。统计显着性设置为 *,p <0.05; **,p <0.01; ***,p <0.001。
gslab:用于荧光显微镜中高级相分析的开源平台
相拟合分析的基础在于使用相组合变换将图像的每个像素映射到二维空间中,称为相分子空间,基于该像素内部跨荧光寿命或光谱尺寸1,2的光子分布。每个像素在相量空间中的位置取决于光子分布的形状,并且独立于信号的强度。通过相量表示的分析不需要对样品的性质或模型的拟合的先验知识。此外,快速傅立叶变换算法的利用可实现快速计算。此分析简化了视觉检查和识别不同像素的种群,随后可以将其映射到原始的荧光图像(或图像集)3。此外,相量转换的数学特性使研究人员能够通过观察相量空间中代表的光子分布的变化来理解样品中发生的现象。在在线方法中提供了分析荧光寿命显微镜图像的相思方法背后的数学概述。
一种用于解释人口的生成建模方法......
摘要。了解神经结构在个体之间的差异对于描述疾病、学习和衰老对大脑的影响至关重要。然而,解开导致个体差异的不同因素仍然是一项艰巨的挑战。在本文中,我们介绍了一种深度生成建模方法来发现许多个体之间的不同变化模式。为此,我们首先在 25 微米分辨率的 1,700 多只小鼠大脑的自发荧光图像集合上训练变分自动编码器。然后,为了利用学习到的因素并验证模型的表现力,我们开发了一种新颖的双向技术来解释潜在空间——通过对网络的高维输入以及瓶颈中的低维潜在变量进行结构化扰动。我们的结果表明,通过将生成建模框架与结构化扰动相结合,可以探测潜在空间以深入了解深度神经网络中形成的大脑结构表征。
作者更正:通过结构模仿大氨基酸的碳量子点对小鼠进行靶向肿瘤治疗诊断
在本文最初发表的版本中,图 4a 中 A549 细胞和图 6b 中 NH 2 -null LAAM TC-CQDs 组显微照片的设置存在错误。原始图片和更正后的图片如下所示。我们还被告知补充信息中的几张图片存在错误。特别是,我们在补充图 20 中意外地使用了几组重复的 RWPE-1、HL-7702、CCC-HPE-2 和 CCC-HIE-2 细胞系图像,在补充图 29 中体内荧光图像下的小鼠图像(一些图像从补充图 56 中重复;在此图中,我们还为 TPTC 组的 0 小时时间点和 TPTC/LAAM TC-CQDs 的 6 小时时间点选择了不正确的图像),在补充图 30 中切除的小鼠器官(一些图像从补充图 38 中重复),以及在补充图 61 中 TPTC/LAAM TC-CQDs 组的心脏和脾脏图像(两张显微照片与盐水组的有重叠)。这些补充图的原始版本和更正版本也在下面重现。所有这些错误都是在从我们使用的核心设施中获取、处理和存储的大量图像数据集中选择代表性图像时发生的。
激酶抑制剂的动力学结合和K
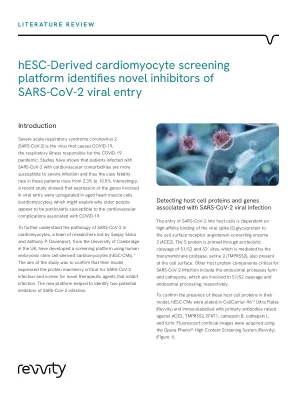
图1:检测与SARS-COV-2病毒感染相关的宿主细胞蛋白和基因。a-f:人类胚胎干细胞衍生的心肌细胞(HESC-CMS)(上)和代表性的荧光图像(n = 6个不同的供体的六个不同供体)人类左心室(人LV)组织(人LV)组织(下部)(下)(下)(下)(下)(下)(下)(下)(下)(n = 6),对人类干细胞衍生的心肌细胞(HESC-CMS)(hESC-CMS)(HESC-CMS)(HESC-CMS)(HESC-CMS)(HESC-CMS)(HESC-CMS)(HESC-CMS)(HESC-CMS)(HESC-CMS)(HESC-CMS)进行了代表性荧光共焦图像(n = 3个独立的实验)。用4%甲醛固定细胞和组织,并用针对ACE2(a),TMPRSS2(b),B0AT1(C),Catherepsin B(d),Catherepsin l(e)和Furin(f)的原代抗体进行免疫标记,并与二次抗体conjugody Conjugy conjugugy conjugugy(f) 33342核标记(蓝色)。g:显示仅用二抗和HOECHST 33342核标记处理的对照细胞(上)和组织(下部)。比例尺显示50μm。h:图形数据显示了观察到的hESC-CM种群在可视化后(背景)呈阳性免疫标记的百分比,其靶向针对概述的蛋白质靶标产生的初级抗体的二抗。i:图形数据显示了hESC-CMS中病毒输入和加工基因表达的百万读数(rpm)±SEM(n = 7在三个不同的区分中重复)和人lv(n = 5个个体)。SLC6A19,CTSB和CTSL分别是编码B0AT1,组织蛋白酶B和组织蛋白酶L的基因。
纸质精子 DNA 完整性分析
设备制造和操作。纸基精子 DNA 分析设备在 PowerPoint 中设计,并使用固体蜡打印机(ColorQube 8570N,加拿大施乐)打印在硝化纤维素纸上(平均孔径为 0.45 μm,加拿大 Bio-Rad Laboratories Ltd.)。然后将图案化的硝化纤维素纸在 125 ºC 下加热 5 分钟,让蜡扩散穿过纸张厚度并从疏水边界扩散。为了将 ICP 功能添加到纸张中,在样品通道的开始处用移液器吸取 0.5 L 阳离子选择性纳米多孔 Nafion(20% 重量,低级脂肪醇和水,Sigma-Aldrich,美国),然后在去离子水中对膜进行水合 30 分钟。设备在室温下风干并在使用后存放在培养皿中。要使用该设备,需要将 3 μL 样品移液到样品通道中,然后用去离子水使设备饱和。通过在样品通道上施加 150 V/cm 的电压 15 分钟来诱导 ICP。在此步骤之后,使用直立荧光显微镜(Axiophot,德国卡尔蔡司公司)捕获绿色(dsDNA)和红色(ssDNA)荧光图像。捕获的图像在 ImageJ 中处理,并使用 Matlab 中的书面脚本进行数据量化。