XiaoMi-AI文件搜索系统
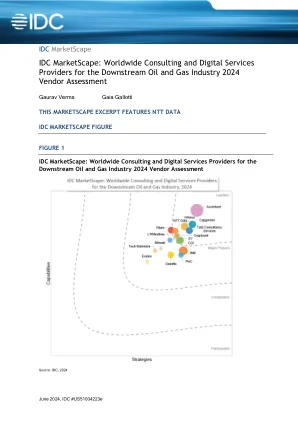
World File Search SystemIDC MarketScape:2024 年下游石油和天然气行业全球咨询和数字服务提供商供应商评估
市场动态、监管压力、环境问题、技术进步和消费者偏好变化等因素正在推动石油和天然气 (O&G) 行业下游领域的业务转型计划。从原油加工到客户体验,下游参与者的传统方法需要在人员、流程、资产和运营效率方面进行多项升级——例如,消除原料合同中的低效率、优化物流管理、改善产品组合以应对实时需求波动、降低炼油厂生产成本、改善最终产品定价、根据实时市场波动改进规划。下游参与者在数字化转型 (DX) 的道路上进展缓慢,在过去几年中,他们比以往任何时候都更希望采用数字技术。这些公司希望通过利用数字技术来优化运营、提高效率和降低成本。这包括使用物联网 (IoT) 传感器、大数据/分析、人工智能和机器学习进行预测性维护、供应链优化和资产管理。 IDC Energy Insights 在 2024 年的最新调查深入研究了下游组织的情绪,并调查了其流程和运营创新领域的状况。这项 2024 年的调查表明,除了常规 IT 支出外,大多数下游组织都在积极投资创新数字解决方案,包括炼油厂数字孪生、数字供应链管理和燃油卡服务创新。
行业领袖投资 9500 万美元.docx
转化为经济的其他部门,其中安全性、弹性和循环寿命是主要的设计要求。Viridi 正在开发安全、弹性和经济高效的即时使用锂离子电池系统,为我们经济的其余 97% 提供动力。”Viridi 的 Green Machine 品牌已成为首款满足建筑和重工业市场需求的锂离子电池组系统的标准,该系统具有长循环寿命、弹性物理设计和完全独立的架构。Green Machine 的便携式锂离子电池系统在实际客户中已有超过 250,000 小时的现场使用时间,预计到 2025 年,北美市场将达到 2050 亿美元。
冰岛 - 欧洲银行业联合会
疫情过后,冰岛经济快速增长,2023 年增长 5%,2021 年至 2023 年平均增长 6.4%。与大多数欧洲国家相比,冰岛的通货膨胀率更高且更持久。冰岛中央银行 (CBI) 一直维持高政策利率,以减缓经济增长并将通胀率降至可接受的水平。通货膨胀率目前正在下降,CBI 已开始降低政策利率。经济出现降温迹象,CBI 预测未来几年的增长率将远低于近期。预计失业率也将从上年的 3.4% 上升到 2025 年的 5%。
第三代半导体碳化硅行业前瞻
图表 9 : SiC 产业链及代表企业 ............................................................................................................................. 6 图表 10 : 导电型碳化硅衬底 ................................................................................................................................. 6 图表 11 : 半绝缘型碳化硅衬底 ............................................................................................................................. 6 图表 12 : WolfSpeed 公司导电碳化硅衬底演进过程 ........................................................................................... 7 图表 13 : SiC 衬底制作工艺流程 ........................................................................................................................... 8 图表 14 : PVT 法生长碳化硅晶体示意图 ............................................................................................................. 8 图表 15 : 用于制备碳化硅的籽晶 ......................................................................................................................... 8 图表 16 : CMP 过程示意图 ................................................................................................................................... 10 图表 17 : CVD 法制备碳化硅外延工艺流程 ........................................................................................................11 图表 18 : SiC 功率器件种类 ............................................................................................................................... 12 图表 19 : SiC-SBD 与 Si-SBD 比较 ..................................................................................................................... 13 图表 20 : SiC-SBD 正向特性 ............................................................................................................................... 13 图表 21 : SiC-SBD 温度及电流依赖性低 ........................................................................................................... 13 图表 22 : SiC-SBD 具有优异的 TRR 特性 ........................................................................................................... 13 图表 23 : SiC MOSFET 与 Si IGBT 开关损耗对比 .............................................................................................. 14 图表 24 : SiC MOSFET 与 Si IGBT 导通损耗对比 .............................................................................................. 14 图表 25 : SiC MOSFET 体二极管动态特性 ......................................................................................................... 14 图表 26 : N 沟道 SiC IGBT 制备技术图 ............................................................................................................. 15 图表 27 : SiC 行业发展阶段曲线 ....................................................................................................................... 16 图表 28 : SiC 市场规模现状及预测 ................................................................................................................... 17 图表 29 : 新能源汽车包含功率器件分布情况 .................................................................................................. 18 图表 30 : 对车载和非车载的器件要求 .............................................................................................................. 18 图表 31 : 车载 OBC 发展趋势 ............................................................................................................................. 19 图表 32 : 硅基材料功率器件的工作极限 ........................................................................................................... 19 图表 33 : 全球新能源汽车碳化硅 IGBT 市场规模 ............................................................................................ 19 图表 34 : 全球新能源汽车市场销量及增长率预测 ............................................................................................ 20 图表 35 : 中国新能源汽车市场销量及增长率预测 ............................................................................................ 20 图表 36 : 2020 年全球新能源乘用车车企销量 TOP10( 辆 ) ................................................................................ 21 图表 37 : 2020 年全球新能源乘用车车型销量 TOP10( 辆 ) ................................................................................ 21 图表 38 : 光伏碳化硅器件优越性 ....................................................................................................................... 22 图表 39 : 全球光伏需求预测 ............................................................................................................................... 22 图表 40 : 全球光伏碳化硅 IGBT 市场规模 ........................................................................................................ 23 图表 41 : 全球光伏 IGBT 市场规模 .................................................................................................................... 23 图表 42 : 2015-2021 年中国累计充电桩数量 ..................................................................................................... 24 图表 43 : 2015-2020 年中国车桩比例 ................................................................................................................. 24 图表 44 : 中国新能源汽车充电桩市场规模及预测 ............................................................................................ 25 图表 45 : 全球充电桩碳化硅器件市场规模 ....................................................................................................... 25 图表 46 : 全球轨道交通碳化硅市场规模及预测 ............................................................................................... 26 图表 47 : 2020 年全球轨道交通运营里程 TOP10 .............................................................................................. 26 图表 48 : 轨道交通碳化硅器件占比预测 ........................................................................................................... 27 图表 49 : 全球轨道交通碳化硅技术采用情况 ................................................................................................... 27 图表 50 : 2015-2025 年中国 UPS 市场规模及预测 ............................................................................................ 28 图表 51 : 2015-2021 年中国 UPS 器件类型情况 ................................................................................................ 28 图表 52 : 2011-2020 年全球 UPS 市场规模及预测 ............................................................................................ 29 图表 53 : 2019-2025 年全球 UPS 碳化硅器件市场规模 .................................................................................... 29 图表 54 : 国外碳化硅衬底技术进展 ................................................................................................................... 30 图表 55 : 碳化硅衬底尺寸市场占比演变 ........................................................................................................... 30
亨特斯角海军造船厂建筑拆除行业日
政府不保证所提供的任何场地相关信息的准确性。政府和/或其代表为支持本次招标而提供的场地相关信息应仅视为信息。此类信息可能包括技术报告和研究、建筑状况报告或旨在支持提议者开发申请的其他技术信息。提议者应核实(而不是仅仅依赖)政府提供的所有场地相关信息,以避免不可预见的成本。
第 11 届 EDF 巴巴多斯可再生能源和能源效率行业预算支持计划
第 11 届 EDF 巴巴多斯可再生能源和能源效率预算支持计划于 2016 年制定,当时该国政治稳定,治理标准良好,机构强大。能源、小企业和创业部最初成立于 1978 年,是贸易部下属的一个“能源司”,基于英国海外发展署 (ODA) 委托的技术援助建议。从那时起,该部逐渐发展成为一个职权范围扩大的组织,负责石油和天然气、可再生能源和节能(已与能源保护部门合并)。该部还为其他政府部门以及私营部门 1 提供地质和地球科学服务。能源、小企业和创业部目前由行政部门、法律和监管部门、自然资源部、可再生能源和能源保护部门、研究和规划部门、项目执行部门和项目监测部门组成。
SpaceTech行业2021 / Q2景观概述< / div>
依靠各种研究方法和分析技术,该报告提供了空间行业的全面概述。这种方法有一定的局限性,尤其是在利用公开可用的数据源和中级研究方面。SpaceTech Analytics对本文介绍的二级数据的质量概不负责;但是,我们会尽力通过使用不同的分析技术和交叉检查数据来消除上述风险。请注意,我们没有故意将某些公司排除在分析之外。也不是由于遇到的数据过滤方法或遇到的困难而引起的。实际上,其不包含的主要原因是可用来源中的不完整或丢失的信息。
行业洞察 - 财务业绩和估值趋势
Transique Corporate Advisors 非常高兴地发布其第十二份行业洞察报告,该报告记录了“服务业”及其子行业(包括航空、BPO/KPO、咨询服务、多元化商业服务、物流解决方案提供商、港口和港口服务、道路资产——收费、年金、混合年金、公路运输、航运和贸易及分销商)三年内的财务业绩和估值趋势。这些趋势基于过去两个审计财年(2020-21 财年和 2021-22 财年)的数据以及截至 2023 年 7 月的过去十二个月 (TTM) 合并财务数据。