XiaoMi-AI文件搜索系统
World File Search SystemIncellipan,INN-大流行性流感疫苗(H5N1)
该药物需要接受额外监控。这将有助于快速识别新的安全信息。要求医疗保健专业人员报告任何疑似不良反应。有关如何报告不良反应的信息,请参阅第 4.8 节。 1. 药品名称 Incellipan 预充式注射器注射混悬液 大流行性流感疫苗 (H5N1)(表面抗原,灭活,含佐剂,在细胞培养中制备)。 2. 定性和定量组成 灭活的流感病毒表面抗原(血凝素和神经氨酸酶)菌株*:菌株类型 A/turkey/Turkey/1/2005 (H5N1) (NIBRG-23) 每 0.5 毫升剂量 7.5 微克** * 在 Madin Darby 犬肾 (MDCK) 细胞中繁殖 ** 以血凝素微克表示。佐剂MF59C.1每0.5毫升剂量含:角鲨烯9.75毫克聚山梨醇酯801.175毫克山梨醇三油酸酯1.175毫克柠檬酸钠0.66毫克柠檬酸0.04毫克该疫苗符合世卫组织的建议和欧盟在正式宣布的大流行情况下的决定。 Incellipan 可能含有微量的β-丙内酯、聚山梨醇酯 80 和十六烷基三甲基溴化铵,这些物质在制造过程中使用(见第 4.3 节)。有关辅料的完整列表,请参阅第 6.1 节。 3. 药物剂型 注射混悬液(注射剂)。乳白色悬浮液。 4. 临床信息 4.1 治疗指征 Incellipan 适用于在正式宣布的流感大流行中对流感进行主动免疫。 Incellipan 应按照官方建议使用。 4.2 剂量和用法用量成人和6个月以上的儿童
用于丙型肝炎筛查,测试的产科技巧表,...
*缩写:Hbsag =乙型肝炎(HEPB)表面抗原; HBV = HEPB病毒;抗HBSAG = HEPB表面抗原的抗体;总抗HBC = HEPB核心抗原的总抗体ϯ最近或当前的注射药物使用,在过去的6个月中多个性伴侣,HBSAG阳性性伴侣,或对性传播感染进行评估或治疗,因为缺乏安全数据,因此不建议进行性传播感染§HBSAG阳性性伴侣。 Twinrix is a combination hepatitis A/hepatitis B vaccine that can be given during pregnancy when indicated( https://www.cdc.gov/vaccines/schedules/hcp/imz/adult.html ) ¶Post-exposure prophylaxis: administer HepB immunoglobulin and HepB vaccine to the infant within 12 hours of birth并通过及时接种疫苗接种并将其通知婴儿的医疗保健提供者,并在疫苗接种后进行了疫苗接种,改编自:Weng MK,Doshani M,Mohammed AK等。19-59岁成年人的普遍丙型肝炎疫苗接种:免疫实践咨询委员会的最新建议 - 美国,2022年。Conners EE,Panagiotakopoulos L,Hofmeister MG等。肝炎病毒感染的筛查和测试:CDC建议 - 美国,2023年。Terrault NA,Bzowej NH,Chang K-M等。AASLD治疗慢性肝炎的指南b。 Hepatology 2016; 63(1):261-83。 Schillie S,Vellozzi C,Reingold A等。 预防美国丙型肝炎病毒感染:免疫实践咨询委员会的建议。AASLD治疗慢性肝炎的指南b。Hepatology 2016; 63(1):261-83。Schillie S,Vellozzi C,Reingold A等。预防美国丙型肝炎病毒感染:免疫实践咨询委员会的建议。
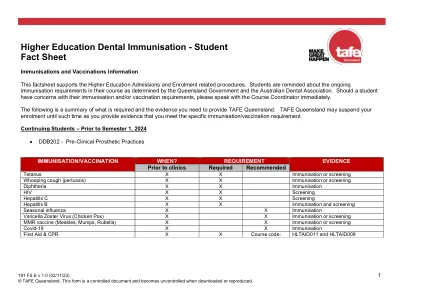
高等教育牙科免疫学生概况
•HEP B的加强剂量不能保证免疫力。必须在2-3周后进行血清学测试,以确认对HEP B的免疫力。•乙型肝炎疫苗接种 - 一系列注射疗程大约需要六(6)个月才能完成,如果申请人没有接受乙型肝炎疫苗接种,则必须在开始义齿诊所开始临床工作之前开始该过程。•您将需要提供血清学报告的副本,以作为与丙型肝炎表面抗原(抗HBSAG)的血清转化的证据。•请联系您的全科医生,安排转诊进行血液检查。•除非他们提供了上述规定的所需证据,否则您将无法开始其临床实践要求。
TROP 2 过表达在特定实体肿瘤中的作用
滋养层细胞表面抗原 2 (TROP2) 受体蛋白,又称 GA733-1 (胃肠道抗原 733-1)、EGP-1 (上皮糖蛋白-1)、TACSTD2 (肿瘤相关钙信号转导子-2),是一种分子量为 36 kDa 的跨膜糖蛋白,最初在正常和肿瘤滋养层细胞中发现 [1, 2]。TROP2 是位于 1p32 染色体上的 TACSTD2 基因的蛋白质产物,该基因是一种细胞原癌基因。其突变导致获得致癌功能,从而决定原发性癌细胞的转化过程及其转移能力。 TROP2蛋白在内质网中合成,然后运输到高尔基体,在那里进行糖基化。其表达在细胞膜表面和细胞质内,膜表达的存在与
研究文章的抑制烤面包酮处理...
乳腺癌是由于复发的高发病率而导致全球妇女癌症死亡率的主要原因之一。常规的乳腺癌治疗包括手术,放疗,化学疗法和荷尔蒙治疗(Ferlay等,2015; Nounou等,2015)。据报道(Al-Ejeh等,2011; Wicha,2008),乳腺癌的复发是由次要癌细胞(称为癌症干细胞(CSC))的少数群体引发的。CSC已被证明具有类似于正常干细胞的特征,例如自我更新,多能性和高存活率。乳腺CSC(BCSC)是异质的,并根据几种表面抗原标记物(例如CD44+,CD24-和ALDH+)鉴定。由于BCSC被认为是造成复发的原因,因此乳腺癌治疗的发展应集中于其消除(Li等,
旧金山VA医疗保健系统
Prescribed and monitored by a VA / VA Community Care hematologist / oncologist Goals of care and role of Palliative Care consult have been discussed and documented Symptomatic intermediate or high-risk myelofibrosis (as determined on initial diagnosis), including primary myelofibrosis or secondary (post-polycythemia vera or post-essential thrombocythemia) myelofibrosis Currently no plan for allogeneic通过触诊(低于肋骨缘低5 cm)或成像东部合作肿瘤学组(ECOG)的造血干细胞移植脾肿大的性能(ECOG)的表现状态为0到2,获得了预处理的完整的血液计数,肝板完整的肝炎,完成了肝炎,最低抗体,抗体至抗血素 - 甲基 - 甲基 - 甲基 - 甲壳虫 - 甲壳虫 - 甲壳虫 - 甲壳虫 - 甲壳虫疗法,(乙型肝炎表面抗原[抗HBS])。
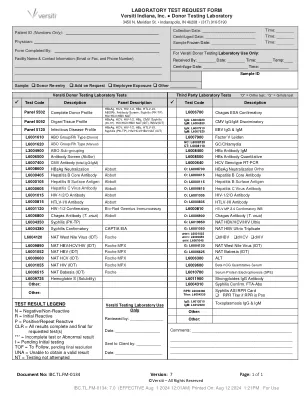
捐赠者测试实验室测试请求表
L3004900 ABO子组L6008400 HBC抗体IGM L6006500抗体筛查(ABSCR)L6008500 HBS抗体定量L6007400 CMV抗体(总IgG/IgM) L6008700 Hbsag中和液压L6000405丙型肝炎核心抗体Abbott O:L6000415丙型肝炎核心抗体L6000105乙型肝炎B表面抗原a abbott a abbott a abbott肝炎病毒抗体L6001015 HIV-1/2/O抗体Abbott O:L6001005 HIV-1/2/O抗体L6000815 HTLV-I/II抗体Abbott O:L6000835 HTLV-I/II抗体L60011 HTASS ASSIN抗体O:L6000835 L6000810 HTLV MP 2.4确认性WB
kesimpta®(Ofatumumab)注射,用于皮下使用
kesimpta是在活跃的乙型肝炎疾病患者中禁忌的。由HBV引起的致命感染以前尚未感染的患者发生在接受Ofatumumab治疗CLL的患者(静脉注射剂量高于MS中推荐的剂量,但治疗时间较短)。HBV筛查应在所有患者接受Kesimpta治疗之前对所有患者进行。至少筛查应包括丙型肝炎表面抗原(HBSAG)和丙型肝炎核心抗体(HBCAB)测试。根据本地准则,可以与其他适当的标记相辅相成。对于HBSAG阴性和HB核抗体阳性的患者[HBCAB+]或HBV [HBSAG+]的载体,请在开始和治疗Kesimpta治疗之前咨询肝病专家。应按照局部医学标准对这些患者进行监测和管理,以防止HBV感染或重新激活。
抗CD22 CAR-T细胞
图1。构造图显示了在抗CD22 CAR-T细胞中表达的抗CD22汽车的组件。背景CD22,也称为SIGLEC-2,是一种几乎普遍表达的B细胞表面抗原。据报道,它充当B细胞受体的抑制性共受体,以控制人体的B细胞反应。2017年,FDA批准了针对B细胞急性淋巴细胞性白血病(全部)患者的抗体 - 药物缀合物CD22的Inotuzumab Ozogamicin(Besponsa)。的结局很差。然而,CD22 CAR-T细胞在临床试验中表现出很高的儿科和成人B-所有人的疗效,为CD22 +恶性肿瘤患者提供了治疗选择,这些患者在CD19导向的嵌合抗原受体(CAR)T细胞疗法中表现出疾病进展。应用程序
Celldemic,INN-人畜共患流感疫苗(H5N1)
此药品需要接受额外监测。这将可以快速识别新的安全信息。请医疗保健专业人员报告任何疑似不良反应。有关如何报告不良反应,请参见 4.8 节。 1. 药品名称 预充式注射器注射用 Celldemic 悬浮液 人畜共患流感疫苗 (H5N1)(表面抗原,灭活,佐剂,在细胞培养中制备)。 2. 定性和定量组成 流感病毒表面抗原(血凝素和神经氨酸酶),灭活,菌株*:A/turkey/Turkey/1/2005 (H5N1) 样菌株 (NIBRG-23)(进化枝 2.2.1) 每 0.5 毫升剂量 7.5 微克** * 在 Madin Darby 犬肾 (MDCK) 细胞中繁殖 ** 以微克血凝素表示。每 0.5 ml 剂量的佐剂 MF59C.1 含有: 角鲨烯 9.75 毫克 聚山梨醇酯 80 1.175 毫克 山梨醇三油酸酯 1.175 毫克 柠檬酸钠 0.66 毫克 柠檬酸 0.04 毫克 Celldemic 可能含有制造过程中使用的 β-丙内酯、聚山梨醇酯 80 和十六烷基三甲基溴化铵的微量残留物(见 4.3 节)。 有关辅料的完整列表,请参阅 6.1 节。 3. 药物形式 注射用混悬液(注射剂)。 乳白色混悬液。 4. 临床特点 4.1 治疗指征 Celldemic 适用于成人和 6 个月及以上的婴儿对甲型流感病毒 H5N1 亚型进行主动免疫。 Celldemic 应按照官方建议使用。 4.2 剂量和给药方法 剂量 成人和 6 个月以上的儿童 Celldemic 以肌肉注射方式给药,每剂 0.5 毫升,每次 2 剂。建议在第一剂 3 周后注射第二剂。