XiaoMi-AI文件搜索系统
World File Search System类视黄酸 X 受体激动剂作为免疫系统的选择性调节剂用于治疗癌症
与其他核受体异二聚化后,类视黄酸 X 受体 (RXR) 可充当配体依赖性转录因子,调节影响癌症众多特征的关键信号通路的转录。通过控制炎症和免疫反应,激活 RXR 的配体可以调节肿瘤微环境。这些必需受体的几种小分子激动剂已被合成。从历史上看,RXR 激动剂被用于抑制癌细胞生长,但最近的药物发现计划筛选出用于抑制炎症或激活免疫细胞的新分子。贝沙罗汀是第一个成功的有效治疗分子靶向 RXR 的例子;这种药物被批准用于治疗皮肤 T 细胞淋巴瘤,目前仍被用作这种疾病的标准治疗方法。目前还没有其他 RXR 激动剂获得 FDA 批准,但正在开发几种有前途的新型化合物。在这篇综述中,我们概述了 RXR 信号调节炎症和肿瘤免疫的多种机制。我们还讨论了 RXR 依赖性免疫细胞调节在治疗或预防癌症方面的潜力以及随之而来的挑战和机遇。
全反式视黄酸与γ-泌尿酶抑制剂crenigacestat协同作用,以增强多发性骨髓瘤的BCMA和B
B细胞成熟抗原(BCMA)是多发性骨髓瘤(MM)中嵌合抗原受体(CAR)T细胞疗法的铅抗原。挑战是在治疗压力下在MM细胞和BCMA下调的BCMA表达中的患者间异质性和患者内异质性。因此,在接受BCMA-CAR T细胞疗法的患者中,人们希望增加和维持MM细胞的BCMA表达。我们使用全反式视黄酸(ATRA)来增强MM细胞上的BCMA表达,并在临床前模型中增加BCMA-CAR T细胞的效率。我们表明,ATRA处理通过定量逆转录聚合酶链反应导致BCMA转录本的增加,并通过MM细胞系和原代MM细胞中流量细胞仪的BCMA蛋白Ex压缩增加。用超分辨率显微镜确认的分析增加了BCMA蛋白的表达,并在ATRA处理后揭示了非簇的BCMA分子在MM细胞膜上的均匀分布。ATRA治疗后,MM细胞上的BCMA表达增强,导致BCMA-CAR T细胞的细胞解,细胞因子的分泌和体外的BCMA-CAR T细胞的增殖,并增加了MM In Vivo(NSG/MM.1S)鼠尾草模型中BCMA-CAR T-CELL疗法的效率。组合MM细胞用ATRA和γ-泌尿酶抑制剂CrenigAcestat进一步增强了BCMA表达和BCMA-CAR T-Cell T-Cell在体外和体内的效果。在一起,数据表明,ATRA处理会导致BCMA在MM细胞上的表达增强,并巧妙地调节BCMA-CAR T细胞的反应性增强。数据支持ATRA与BCMA-CAR T细胞治疗以及其他BCMA指导的免疫疗法的临床评估。
蕈样肉芽肿 - 介绍
• 常规治疗方案与牛皮癣和湿疹相同。 • 特殊情况下,维持治疗-PUVA 1x/周-2 周。 • 可与以下方案联合使用:IFNα 3x 每周 3x10 6 IU 或类视黄酸
多层法分析揭示了一个非古典视黄酸信号传导轴,该轴调节造血干细胞身份
2008; Till and McCulloch,1961)。 hsc可以引起多能祖细胞(MPP),该祖细胞将逐步分为谱系的祖细胞,最终分为效应细胞(Ikuta和Weissman,1992; Okada等,1992)。 在稳态条件下,HSC是高度静止的,并且表现出低的生物合成活性(Cabezas-Wallscheid等,2017; Wilson等,2008)。 尽管目前有辩论,但HSC通常描述了依赖糖酵解ATP产生的TA,同时抑制线粒体氧化磷酸化(OXPHOS)(Chandel等,2016; Ito and Suda,2014; Liang et al。,Liang等,2020; Vannini等,2016)。 尽管如此,HSC必须能够在压力引起的激活后可逆地切换其代谢程序,以满足更高的能量需求并驱动分化(Ito和Suda,2014; Ito等,2019; Simsek et al。,2010; Takubo等,2013)。2008; Till and McCulloch,1961)。hsc可以引起多能祖细胞(MPP),该祖细胞将逐步分为谱系的祖细胞,最终分为效应细胞(Ikuta和Weissman,1992; Okada等,1992)。在稳态条件下,HSC是高度静止的,并且表现出低的生物合成活性(Cabezas-Wallscheid等,2017; Wilson等,2008)。尽管目前有辩论,但HSC通常描述了依赖糖酵解ATP产生的TA,同时抑制线粒体氧化磷酸化(OXPHOS)(Chandel等,2016; Ito and Suda,2014; Liang et al。,Liang等,2020; Vannini等,2016)。尽管如此,HSC必须能够在压力引起的激活后可逆地切换其代谢程序,以满足更高的能量需求并驱动分化(Ito和Suda,2014; Ito等,2019; Simsek et al。,2010; Takubo等,2013)。
2024 IBIDI日历
“通道连接”是视黄酸诱导的羊膜源性多冰层水凝胶上神经干细胞分化的神经元网络形成的共聚焦显微镜图像。使用Tuj1(绿色)标记神经元,而核则使用带有DAPI(蓝色)的Ibidi安装培养基对其进行了反染色。使用具有10倍物镜的900公里共聚焦显微镜的Zeiss LSM获得图像。
精神分裂症相关基因AS3MT的功能表征鉴定出在神经元发育中的作用。
图4在分化的AS3MT敲除和野生型细胞系之间未观察到形态差异:使用10μM视黄酸的细胞系在7天内使用10μM视黄酸和1%FBS在酸蚀刻,层粘连蛋白和多赖氨酸和多赖氨酸覆盖的覆盖物上覆盖,以获取MAP2,以获取MAP2,以获取cytoskeposkemeleckkeletalsmembeletalmarkeral。(a)敲除(KO)或野生型(wt)AS3MT线之间的MAP2 +单元总数没有差异(t检验,T [0.875] = 1.19,p = 0.523)b)kO和WT AS3MT线之间的细胞面积没有差异(T AS3MT test test,t test,T [1.98] [1.98] = 1.198],P。c)KO和WT AS3MT线之间的最长神经突长度没有差异(t检验,t [1.99] = 1.10,p = 0.386)。d)KO和WT AS3MT线之间的总神经突长度没有差异(t检验,t [1.11] = 0.937,p = 0.508)。在两个独立的KO/WT细胞系上进行了三个技术重复,进行了每个实验。条代表每个基因型的两个细胞系的平均值。错误是平均值±SEM
名称:Peter McCaffery Center/单位:医学科学学院大学:Aberdeen Post标题:IMS神经生物学教授兼主管Web
名称:Peter McCaffery Center/单位:医学科学学院大学:Aberdeen帖子标题:IMS Neurobiology教授兼主管Web-Site:http://www.abdn.ac.uk/ims/staff/staff/details.php/details.php?id=p.j.j.mccaffery 1。研究输出 - 最近的一些相关出版物Bremner JD,Shearer KD,McCaffery p。视网膜酸和情感障碍:关联的证据。临床精神病学杂志(出版社,2011年)。Shearer KD,Goodman TH,Ross AW,Reilly L,Morgan PJ,McCaffery PJ。下丘脑中视黄酸信号传导的光周期调节。神经化学杂志112,246-57(2010)。Silvestri C,Narimatsu M,Von I,Liu Y,Tan NB,Izzi L,McCaffery PJ,Wrana JL,Attisano L.识别SMAD/FOXH1靶标的全基因组方法揭示了FOXH1在减虫酸调节和后代大脑中的关键作用。发育细胞14,411-23(2008)。Bremner JD,McCafferyP。情感疾病中视黄酸的神经生物学。神经药理学与生物精神病学的进展15,315-31(2008)
视黄酸介导的稳态可塑性驱动细胞类型特异性的CP-Ampar在伏伏核中的核心中累积和可卡因渴望的孵化
。cc-by-nc-nd 4.0国际许可证(未经同行评审证明)获得的是作者/资助者,他授予Biorxiv授予Biorxiv的许可,以永久显示预印本。这是该版本的版权持有人,该版本发布于2024年9月14日。 https://doi.org/10.1101/2024.09.12.611703 doi:Biorxiv Preprint
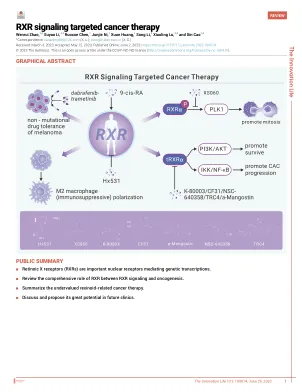
RXR 信号靶向癌症治疗 - 创新
4 这些作者对这项工作做出了同等贡献。 *通信:luxiaoling80@126.com(XL);caox@fudan.edu.cn(XC) 收到:2023 年 3 月 3 日;接受:2023 年 5 月 12 日;在线发表:2023 年 6 月 2 日;https://doi.org/10.59717/j.xinn-life.2023.100014 © 2023 作者。这是一篇根据 CC BY-NC-ND 许可开放获取的文章(http://creativecommons.org/licenses/by-nc-nd/4.0/)。引用:Zhao W.、Li S.、Chen R. 等人,(2023 年)。RXR 信号靶向癌症治疗。创新生命 1(1), 100014。视黄酸 X 受体 (RXR) 是调节癌细胞中一系列基因转录的关键因素,因为它与三分之一的核受体 (NR) 形成异二聚体。然而,以 RXR 为靶点的癌症治疗被大大低估了。贝沙罗汀 (Targretin®) 是第一个合成的视黄酸类药物,于 2000 年获得美国食品和药物管理局批准用于治疗难治性皮肤 T 细胞淋巴瘤。此后,研究人员开始更多地关注 RXR 的功能和 RXR 的修饰,例如磷酸化-RXRα (p-RXRα) 和截短的 RXRα (tRXRα)。同时,由于RXR在肿瘤发生中具有重要而全面的调控作用,调节RXR的药物因具有干扰癌细胞增殖、分化和凋亡的潜力而开始引起肿瘤学家的更多兴趣。本文,我们将综述RXR在RXR信号传导和肿瘤发生之间的综合作用,重点关注被低估的与Rexinoid相关的癌症治疗,并讨论和提出其在未来临床中的巨大潜力。
对于JHRR的贡献,请通过电子邮件联系:editor@jhrlmc.com,基于虚拟现实的康复计划的原始文章有效性与
摘要。精子干细胞(SSC)具有重新殖民的独特能力,可以重新定殖。在微注射中,将精神小管的腹腔隔室通过血液测试屏屏障(BTB)转移到小管的基础室,并重新启动精子发生。最近发现,WIN18,446抑制视黄酸信号传导通过瞬时抑制精子分化,从而增强了SSC定植,从而促进了生育能力的恢复。在这项研究中,我们报告说Win18,446通过破坏BTB来增加SSC定殖。Win18,446改变了紧密连接蛋白(TJP)的表达模式,并破坏了Busulfan处理的小鼠中的BTB。Win18,446上调了FGF2的表达,FGF2是SSC的自我更新因素之一。虽然Win18,446在Busulfan治疗的野生型小鼠中增强了SSC殖民化,但它并没有增加缺乏BTB的Busulfan治疗的CLDN11缺乏小鼠的定殖水平,这表明缺乏BTB,这表明在野生型睾丸中增强了BTB的损失。串行移植分析显示,Win18,446引起的自我更新受损,表明Win18,446介导的视黄酸信号传导抑制了SSC自我更新。引人注目的是,Win18,446政府导致45%的Busulfan处理的受体小鼠死亡。这些发现表明,TJP调制是Win18,446增强SSC归宿的主要机制,并引起了人们对使用Win18,446进行人类SSC移植的担忧。关键词:血睾丸屏障,归巢,精子,Win18,446