XiaoMi-AI文件搜索系统
World File Search System处方信息重点 这些重点不包括安全有效地使用 ORGOVYX 所需的所有信息。请参阅完整处方
完整处方信息 1 适应症和用途 ORGOVYX 适用于治疗患有晚期前列腺癌的成年患者。 2 剂量和给药 2.1 推荐剂量 第一天以 360 mg 的负荷剂量开始 ORGOVYX 治疗,并继续治疗,每天大约同一时间口服 120 mg 剂量一次。ORGOVYX 可以与食物一起服用或单独服用 [见临床药理学 (12.3)]。指导患者将药片整个吞下,不要压碎或咀嚼药片。建议患者在记起时立即服用错过的 ORGOVYX 剂量。如果错过剂量超过 12 小时,患者不应服用错过的剂量并继续服用下一次预定的剂量。如果 ORGOVYX 治疗中断超过 7 天,则在第一天以 360 mg 的负荷剂量重新开始使用 ORGOVYX,并继续以每天一次 120 mg 的剂量服用。对于使用 GnRH 受体激动剂和拮抗剂治疗前列腺癌的患者,通常在出现非转移性或转移性去势抵抗性前列腺癌后继续治疗。2.2 与 P-gp 抑制剂一起使用时的剂量调整避免将 ORGOVYX 与口服 P-gp 抑制剂共同给药。如果无法避免共同给药,请先服用 ORGOVYX,然后至少间隔 6 小时服用[见药物相互作用 (7.1) 和临床药理学 (12.3)]。如果需要使用 P-gp 抑制剂进行短期治疗,则 ORGOVYX 治疗可中断长达两周。 2.3 与 P-gp 和强 CYP3A 诱导剂联合使用时的剂量调整 避免将 ORGOVYX 与 P-gp 和强 CYP3A 诱导剂联合使用。如果无法避免联合使用,则将 ORGOVYX 剂量增加至每天一次 240 毫克。停止使用 P-gp 和强 CYP3A 诱导剂联合使用后,恢复推荐的 ORGOVYX 剂量 120 毫克,每天一次 [见药物相互作用 (7.1) 和临床药理学 (12.3)]。 3 剂型和规格 片剂:120 毫克,浅红色,杏仁形,薄膜包衣,一面压印“R”,另一面压印“120”。
基因组引入的含义和教训...
胃癌仍然是全球癌症死亡率的主要因素之一,尽管诊所中没有有希望的靶标药物。因此,紧急鉴定出新的针对胃癌的靶向药物。是诱导胃癌治疗的铁铁作用的有前途的策略,该诱导剂是一种潜在的药物。尽管如此,尚未进入诊所。因此,我们的目的是使用药物重新利用策略来鉴定一种用于胃癌治疗的新型铁铁作用诱导剂。首先,使用商业化复合文库的药物重新利用策略,小分子生物活性catsper通道阻滞剂HC-056456的特征是抑制胃癌生长MGC-803的生长。同时,这种抗增殖作用可以被铁蛋白1(一种抑制剂铁蛋白-1)阻止,表明HC-056456是一种诱导HC-056456。然后,鉴定出HC-056456通过p53/slc7a11信号通路降低GSH含量。然后,当细胞暴露于HC-056456时,累积了Fe 2+和脂质过氧化物。最后,发现HC-056456通过增加p53并在体内抑制SLC7A11,但在Ferrostatin-1的存在下抑制了SLC7A11,从而抑制了胃癌细胞的生长。总的来说,我们系统地阐明了HC-056456通过在体外和体内引起的铁毒性作用,从而发挥抗震颤癌症的作用,这表明其在胃癌治疗中的潜在作用。
对在线关注和对二氧化碳去除的积极情感
癌症生长[17]。 我们怀疑MM细胞中DCG066诱导的凋亡模式与甲状腺毒作用有关,因此我们预先处理了ARH-77和RPMI-8226细胞具有氧化肌毒化抑制剂(FER-1)的RPMI-8226细胞,并通过添加DCG0666666666的诱导剂,并通过添加了MOSTBIDEBSBIDEBSBIDED。 我们发现,与单独的MM细胞中的DCG066处理组相比,Erastin和Fer-1能够很好地逆转和促进DCG066诱导的凋亡(图癌症生长[17]。我们怀疑MM细胞中DCG066诱导的凋亡模式与甲状腺毒作用有关,因此我们预先处理了ARH-77和RPMI-8226细胞具有氧化肌毒化抑制剂(FER-1)的RPMI-8226细胞,并通过添加DCG0666666666的诱导剂,并通过添加了MOSTBIDEBSBIDEBSBIDED。我们发现,与单独的MM细胞中的DCG066处理组相比,Erastin和Fer-1能够很好地逆转和促进DCG066诱导的凋亡(图4a,p <0.001)。随后,用不同浓度(0,3 µm,5 µm,8 µm)的DCG066对ARH-77和RPMI-8226细胞进行处理,效力诱变的主要调节剂的蛋白质水平(GPX4和SCL7A11)(GPX4和SCL7A11)分析了GPX11的蛋白质水平。 DCG066浓度(图4b)。因此,我们假设DCG066导致MM
参考编号:5477197 - accessdata.fda.gov
5.9 与 CYP3A4 抑制剂或诱导剂的相互作用 ...................................... 7 6 不良反应 .............................................. 8 6.1 临床试验经验 .............................................. 8 7 药物相互作用 .............................................. 10 7.1 其他药物对 VONJO 的影响 ........................ 10 7.2 VONJO 对其他药物的影响 ........................ 10 8 在特定人群中的使用 ...................................... 12 8.1 怀孕 ...................................................... 12 8.2 哺乳 ...................................................... 12 8.3 具有生殖潜力的女性和男性 ............................................. 13 8.4 儿童用药 ...................................................... 13 8.5 老年人用药 ............................................................. 13 8.6 肝功能不全 ............................................................. 13 8.7 肾功能不全 ............................................................. 13
Guðjón Trausti Skúlason,aAlexander H. Åstrand,b Pål ...
该项目由奥斯陆大学和卑尔根大学共同发起,自 2013 年以来一直活跃。最初,该项目源于分离和发现碘素,一种接近粘菌素的衍生物,可作为人类白血病细胞凋亡的强效和选择性诱导剂。后来,我们开始探索碘素和粘菌素的合成衍生物的抗菌活性,因为许多吩嗪已知具有抗菌活性。该项目已经获得了两项专利。
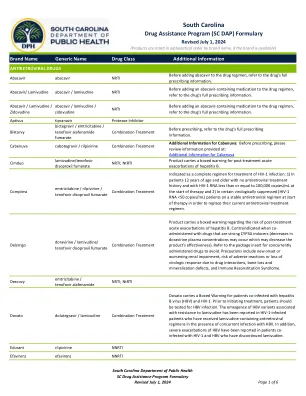
药物援助计划 (SC DAP) 处方集
产品带有黑框警告,警告患者治疗后乙肝急性加重的风险。与强效 CYP3A 诱导剂合用时禁用(多拉韦林血浆浓度可能会降低,从而降低产品有效性)。请参阅包装说明书,了解应避免同时服用的药物。注意事项包括新发或恶化的肾功能损害、因药物相互作用导致不良反应或病毒学反应丧失的风险、骨质流失和矿化缺陷以及免疫重建综合征。
一种简单的机制,用于整合圆霍乱中的法定人数传感和cAMP信号
摘要许多细菌使用法定人数传感来控制生活方式的变化。该过程由微生物衍生的“自动诱导剂”信号分子进行调节,这些信号分子积聚在局部环境中。单个细胞感知自动诱导剂的丰度,推断人口密度并相应地改变其行为。在纤维霍乱中,磷光灯传递到转录因子luxo中,群体感应信号被转导。未磷酸化的Luxo允许HAPR的表达,从而改变了整体基因表达模式。在这项工作中,我们绘制了V. Cholerae中Luxo和Hapr的全基因组分布。尽管Luxo有一个小的法规,但HAPR目标32位。许多HAPR靶标与调节对碳饥饿的转录反应的CAMP受体蛋白(CRP)位点一致。这种重叠(在其他弧菌物种中也很明显)是由每个因子结合的DNA序列中的相似性引起的。在共享位点,HAPR和CRP同时接触双螺旋,并通过两个因素的直接相互作用稳定结合。重要的是,这涉及CRP表面,通常接触RNA聚合酶以刺激转录。因此,HAPR可以通过CRP阻止转录激活。因此,通过在共享位点进行交互,HAPR和CRP整合了来自法规传感和cAMP信号传导的信息以控制基因表达。这可能会使V.霍乱在水生环境和人类宿主之间的过渡过程中调节基因子集。
利用小分子泛 KRAS 降解剂靶向癌症
作为高度协同(α= 479,表 S1)和高亲和力的三元复合物诱导剂(在没有或存在 KRAS G12D 的情况下,KD = 7 187 nM vs 15 nM)(图 1C,表 S1)。我们通过 SPR 正交证实了三元复合物的形成,三元复合物解离半衰期(t 1/2)为 159 s,平衡解离常数(KD )为 20 nM(图 1D,表 S1)。化合物 2 剂量依赖性地降解 GP5d 细胞中的 KRAS G12D 10
健康产品安全信息摘要
降低风险HCP在治疗之前和整个治疗过程中应考虑涉及Camzyos的药物相互作用的潜力,包括与非处方药(例如Omeprazole或Esomeprazole)和草药补充剂共同给药的药物相互作用。camzyos禁忌使用中度至强CYP2C19抑制剂或强CYP3A4抑制剂。在启动或更改弱CYP2C19抑制剂或中等CYP3A4抑制剂时,请参阅对CYP2C19或CYP3A4诱导剂或抑制剂的伴随疗法或抑制剂,以进行CAMZYOS剂量调整和LVEF监测建议。
SiO2纳米颗粒对聚乙烯醇/ ... div>的影响免疫原性细胞死亡的癌症疫苗
肿瘤免疫疗法是解决常规肿瘤疗法的局限性(例如化学疗法和放疗)的有前途的方法,这些方法通常具有副作用,并且无法防止复发和转移。但是,免疫激活在肿瘤免疫疗法中的有效性和可持续性仍然具有挑战性。肿瘤免疫原性细胞死亡,其特征是免疫原性物质,损伤相关的分子模式(抑制作用)和与肿瘤相关的抗原(DTC)提供了潜在的溶液。通过包含更多免疫原性抗原和刺激因子来增强DTC的免疫原性,可以开发出免疫原性细胞死亡(ICD)癌症疫苗作为免疫疗法的强大工具。将ICD纳米诱导剂整合到常规疗法中,例如化学疗法,光动力疗法,光热疗法,声动力疗法和放射疗法提出了一种新的策略,以增强治疗效果并有可能改善患者结局。临床前研究已经确定了许多潜在的ICD诱导剂。但是,将这些发现有效地转化为临床相关的应用仍然是一个至关重要的挑战。本综述旨在通过为基于ICD的癌症疫苗的体外制备提供宝贵的见解来为这项努力做出贡献。我们探索了既定的ICD归纳工具,然后探索了个性化ICD归纳策略和疫苗设计。通过共享这些知识,我们希望刺激基于ICD的癌症疫苗领域的进一步发展和进步。