XiaoMi-AI文件搜索系统
World File Search System辉瑞 5-11 年疫苗的包装和使用期限
检查外包装箱上是否已标注了有效期和解冻日期。纸箱上的标签应反映冷藏有效期和原始有效期。必须使用较早的日期。工作组要求您在进行交货验收报告时记录每次交货的有效期。 辉瑞和 Moderna 疫苗的解冻/解冻有效期与使用日期 重要的是要注意 mRNA 疫苗(Moderna 和 Pfizer)的解冻/解冻有效期和使用日期之间的差异:
辉瑞-BioNTech/Comirnaty COVID-19 mRNA 疫苗
在研究 4(一项安慰剂对照加强研究)中,从研究 2 中招募的 16 岁及以上的参与者在接种第二剂辉瑞-BioNTech/Comirnaty COVID-19 mRNA 疫苗后至少 6 个月接受了辉瑞-BioNTech/Comirnaty COVID-19 mRNA 疫苗加强剂(5,081 名参与者)或安慰剂(5,044 名参与者)。总体而言,在盲法安慰剂对照随访期内,接种加强剂后的中位随访时间为 2.8 个月(范围为 0.3 至 7.5 个月),截至截止日期(2022 年 2 月 8 日)。其中,1,281 名受试者(895 名辉瑞-BioNTech/Comirnaty COVID-19 mRNA 疫苗受试者和 386 名安慰剂受试者)在接种辉瑞-BioNTech/Comirnaty COVID-19 mRNA 疫苗加强剂量后接受了 ≥4 个月的随访。未发现辉瑞-BioNTech/Comirnaty COVID-19 mRNA 疫苗的新不良反应。
辉瑞-biontech Covid-19疫苗的事实说明书
美国食品药物管理局(FDA)已发布紧急用途授权(EUA),以允许未经批准的产品Pfizer-Biontech Covid-19疫苗进行紧急使用,以防止在12岁和年龄较大的个人中为个人和年龄较大的人提供三分之一的年龄和年龄较大的人,以防止在某些年龄和年龄较大的人中为某些人提供某种剂量的人,以防止COVID-19,以确定某些年龄较大的人。comirnaty(covid-19疫苗,mRNA)是辉瑞公司对Biontech生产的FDA批准的COVID-19疫苗。它被批准为16岁及以上的个体预防COVID-19的2剂系列,还被授权在12至15岁的个体中进行紧急用途,并为12岁及以上的个人提供第三剂,他们决定拥有某些类型的免疫敏感性。由FDA批准的Comirnaty(Covid-19疫苗,mRNA)和由EUA授权的Pfizer-Biontech Covid-19疫苗具有相同的配方,可以互换使用以提供COVID-19疫苗接种系列。1 SUMMARY OF INSTRUCTIONS FOR COVID-19 VACCINATION PROVIDERS Vaccination providers enrolled in the federal COVID-19 Vaccination Program must report all vaccine administration errors, all serious adverse events, cases of Multisystem Inflammatory Syndrome (MIS) in adults and children, and cases of COVID-19 that result in hospitalization or death following administration of Pfizer-BioNTech COVID-19 Vaccine.请参阅“在紧急使用授权下对Pfizer-Biontech Covid-19的强制性要求”。辉瑞-biontech covid-19疫苗是肌肉注射的悬浮液,该注射量为一系列两剂(每个0.3毫升)相距3周。第三剂量在第二剂疫苗后至少28天服用的辉瑞-biontech Covid-19疫苗(0.3 mL)被授权给至少12岁的个体进行固体
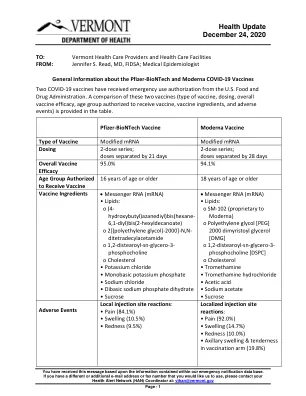
关于辉瑞-BioNTech 和 Moderna COVID-19 疫苗的一般信息
应向疫苗接种者告知预期的全身和局部副作用。根据疫苗产品(辉瑞-BioNTech 与 Moderna),大约 80-89% 的接种者在接种疫苗后会出现至少一种局部症状,55-83% 的接种者会出现至少一种全身症状。接种 Moderna 疫苗的人中,有以下情况的人数比例较大:1) 腋窝肿胀和压痛;2) 恶心和呕吐更多(与接种辉瑞-BioNTech 疫苗的人相比)。
COVID-19辉瑞Biontech或Moderna疫苗接种
对上述接收者进行COVID-19疫苗的管理请求:我承认我已经收到了疫苗信息声明或紧急使用授权信息表和田纳西州卫生部的隐私惯例通知。我有机会提出有关疫苗的问题并了解风险和福利。我知道,为了防止导致Covid-19的病毒,可能需要两次相同的疫苗。我承认,我可能会收到第二次剂量的提醒(如果提供的手机号码,可以适用标准消息率),电话或邮件。
有关辉瑞的COVID-19 mRNA疫苗BNT 162B2
与任何疫苗一样,covid-19 mRNA疫苗BNT162B2可能无法完全保护所有接收的人。当前,免疫系统弱的个体或正在服用抑制或阻止免疫反应的长期治疗的人都没有数据。可以将疫苗提供给儿童和青少年吗?COVID-19不建议16岁以下的儿童使用mRNA疫苗BNT162B2。如何在稀释后给出covid-19 mRNA疫苗Bnt162b2在稀释后给出covid-19 mRNA疫苗Bnt162b2,作为注射0.3 mL的上臂肌肉。COVID-19 MRNA疫苗BNT162B2是否含有钠和钾?该疫苗含有钾,每剂量小于1 mmol(39 mg),即本质上是“无钾”。该疫苗的每剂量含量小于1 mmol钠(23 mg),即基本上是“钠无钠”。疫苗还包含什么?
辉瑞疫苗疫苗患者信息此药物...
•如果您对活性物质或该药物的其他任何成分过敏(第5节中列出)。过敏反应的迹象可能包括皮疹发痒,呼吸急促和脸部或舌头肿胀。立即与您的医生或医疗保健专业人员联系,如果您有过敏反应,请立即去最近的医院急诊室。这可能是威胁生命的。
2024-25 辉瑞 COVID-19 疫苗(12 岁以上)
最近感染过 COVID-19 的人可能会考虑推迟接种疫苗,但一旦感觉好转就可以接种疫苗。请咨询您的医疗保健提供者以获取最新建议。 正在接受免疫抑制药物治疗或患有影响神经系统的自身免疫性疾病的人应联系他们的医疗保健提供者以确定接种疫苗的最佳时间。 干细胞移植接受者在接种疫苗前必须咨询他们的医疗保健提供者。 有多系统炎症综合征病史的人应该等到临床康复后再接种疫苗,包括恢复到基线心脏功能;并且距离诊断至少已过去 90 天。 在之前接种 COVID-19 疫苗后患上心肌炎(心脏炎症)或心包炎(心脏外层炎症)的人应在接种疫苗前咨询他们的医疗保健提供者。
COVID-19 疫苗(辉瑞-BioNTech、Moderna、Novavax)
A. 已知感染 COVID-19 的患者应等到症状消退且符合标准后才能停止隔离。有 COVID-19 病史的人如有其他指征应接种疫苗。如果需要,急性 COVID-19 患者最多可等待 90 天才能接种疫苗,因为 90 天内再次感染的情况并不常见。不建议仅出于疫苗决策目的而进行病毒检测以评估急性 SARS-CoV-2 感染或血清学检测以评估先前感染。
辉瑞报告 2022 年第一季度业绩
▪ 2022 年全年财务指引 (4) 调整后摊薄每股收益 (3) 修订为 6.25 美元至 6.45 美元的范围,仅反映会计政策变更带来的 0.11 美元负面影响,将所有收购的在研研发费用 (4) 纳入调整后 (3) 结果中 - 运营增长抵消了不利外汇造成的 0.11 美元的额外负面影响