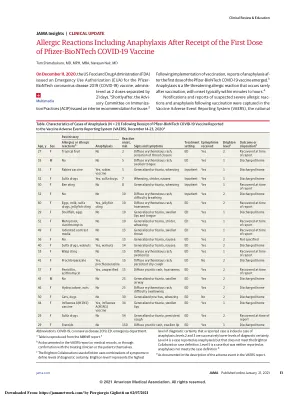
美国食品药物管理局(FDA)已发布紧急用途授权(EUA),以允许未经批准的产品Pfizer-Biontech Covid-19疫苗进行紧急使用,以防止在12岁和年龄较大的个人中为个人和年龄较大的人提供三分之一的年龄和年龄较大的人,以防止在某些年龄和年龄较大的人中为某些人提供某种剂量的人,以防止COVID-19,以确定某些年龄较大的人。comirnaty(covid-19疫苗,mRNA)是辉瑞公司对Biontech生产的FDA批准的COVID-19疫苗。它被批准为16岁及以上的个体预防COVID-19的2剂系列,还被授权在12至15岁的个体中进行紧急用途,并为12岁及以上的个人提供第三剂,他们决定拥有某些类型的免疫敏感性。由FDA批准的Comirnaty(Covid-19疫苗,mRNA)和由EUA授权的Pfizer-Biontech Covid-19疫苗具有相同的配方,可以互换使用以提供COVID-19疫苗接种系列。1 SUMMARY OF INSTRUCTIONS FOR COVID-19 VACCINATION PROVIDERS Vaccination providers enrolled in the federal COVID-19 Vaccination Program must report all vaccine administration errors, all serious adverse events, cases of Multisystem Inflammatory Syndrome (MIS) in adults and children, and cases of COVID-19 that result in hospitalization or death following administration of Pfizer-BioNTech COVID-19 Vaccine.请参阅“在紧急使用授权下对Pfizer-Biontech Covid-19的强制性要求”。辉瑞-biontech covid-19疫苗是肌肉注射的悬浮液,该注射量为一系列两剂(每个0.3毫升)相距3周。第三剂量在第二剂疫苗后至少28天服用的辉瑞-biontech Covid-19疫苗(0.3 mL)被授权给至少12岁的个体进行固体
辉瑞-biontech Covid-19疫苗的事实说明书
主要关键词