XiaoMi-AI文件搜索系统
World File Search SystemAIM Vaccine Co., Ltd. 艾美疫苗股份有限公司
The 2024 Corporate Day event (the “ Event ”) of AIM Vaccine Co., Ltd. (“ AIM Vaccine ” or the “ Group ”) was successfully held on November 21, 2024. The theme of the Event is “Persisting in Forging Honor, Leading Innovation with Action”. 57 securities firms and institutional investors, including CITIC Securities ( 中信证券), Guotai Junan ( 国泰君安), Shenwan Hongyuan ( 申万宏源), Huaxin Securities ( 华鑫证券), Guosheng Securities ( 国盛证券), Everbright Securities ( 光大证券), China Merchants Capital ( 招商局资本), Chengtong Fund ( 诚通基金), Wisdomshire Asset Management ( 睿郡资产), and Tasly Capital ( 天士力资本), as well as some industry experts, were invited to the Event. The attendees visited the modern production base of the Group, learned about the production process, and exchanged ideas with senior management of the Group on the blockbuster large single product vaccines that the Group has applied for launch, as well as our product pipeline layout, product export strategy, and future development plans. The agenda of the Event is as follows:
年度的年度业绩公告...
中国是全球最大的狂犬病疫苗市场。根据中国见解咨询公司的说法,在产品创新和迭代以及对狂犬病疫苗的可访问性的推动下,预计到2030年,市场规模将达到148亿元。按照“国家疾病控制和预防管理局和国家卫生委员会,狂犬病预防和治疗诊所发行的“狂犬病暴露预防和治疗指南(2023版)”(2023年)”(2023年)。利用其迭代技术优势,该集团的产品有望成为疫苗接种机构的首选。
AIM Vaccine Co., Ltd. 艾美疫苗股份有限公司
与传统的Vero细胞狂犬病疫苗和人二倍体狂犬病疫苗完全不同,该组开发的无迭代血清狂犬病疫苗是迭代升级的产品。动物血清残基是导致不良反应的重要因素之一,例如接种疫苗的人群过敏,该组开发的无血清狂犬病疫苗不含动物血清,这显着提高了安全性并降低了不良反应的可能性。迄今为止,尚无批准在全球市场发射的批准的无血清狂犬病疫苗,预计该产品将成为市场上的第一个。
2023环境社会和治理报告
最近从国家医学产品管理局获得了该组开发的人类二倍体狂犬病疫苗的临床试验批准。该产品作为一种迭代升级的人二倍体狂犬病疫苗,具有超高效率的特征,并且标志着全球狂犬病疫苗行业的技术迭代升级。动物测试的结果表明,该组的人类二倍体狂犬病疫苗会触发高水平的抗体,这些抗体在免疫后提供了足够的保护。在同一剂量下,该集团人类二倍体狂犬病疫苗的效力显着高于那些销售的人二倍体狂犬病疫苗。
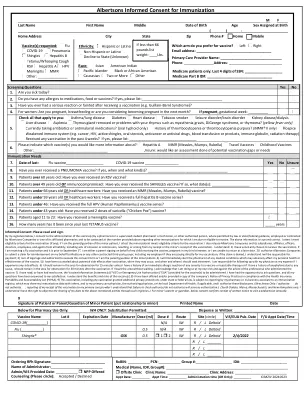
艾伯森免疫知情同意书
知情同意书:请阅读并签字。通过以下签名,我同意由 Albertsons Companies 或其附属药房之一雇用或签约的药剂师、受监管的学生药剂师或技术员或其他授权人员在法律或州/联邦指导允许的情况下为我接种疫苗,并同意通过上述号码联系他们,了解我应接种或有资格接种的其他免疫接种。以上信息真实准确。我证明我符合接种疫苗的资格标准(如有);如果我是未成年患者的父母/监护人,我证明未成年患者符合接种疫苗的资格标准。我还免除 Albertsons Companies 及其子公司、附属公司、管理人员、董事、员工和代理人因我或未成年人接种此疫苗而导致或产生的所有责任,包括疏忽或作为。我理解:1) 我自愿选择接种疫苗。如果我在 9 月 1 日之前接种流感疫苗,则我要么是代表接种疫苗的孩子签字的家长,要么是怀孕到晚期,要么是我无法在以后返回。2) 我授权 Albertsons Companies 代表我向 Medicare 或任何其他签约的第三方付款人(包括我的雇主,如果他们直接支付我的疫苗接种费用)提交报销申请;如果申请被拒绝,我明白我将负责付款;3) 我已达到法定年龄并被授权签署此同意书,或者我是未成年患者的父母/监护人。4) 我将立即告知药剂师任何可能对我个人健康或疫苗有效性产生不利影响的医疗状况。5) 我已经被告知接种疫苗后的潜在副作用、可能出现的时间以及我应该在何时何地寻求治疗。如果我出现任何副作用,我有责任自费去看我的医生。 6) 我应该留在该区域观察 15 分钟,除非我曾经对疫苗或注射疗法有过任何严重的即时过敏反应,或者我曾经因任何原因而出现过敏反应,否则我应在接种疫苗后留在该区域观察 30 分钟。如果我不等待就离开该区域,我承认我这样做是自担风险,并且违反了接种疫苗的专业人员的建议。 7) 我已阅读或已让其他人向我宣读了疫苗信息声明(“VIS”)或紧急使用授权(“EUA”)。我有机会提出问题,我的所有问题都得到了满意的答复。我了解疫苗的益处和风险。8) 我已获得公司根据《健康保险流通与责任法案》(HIPAA)提供的隐私惯例通知副本。9) 本次疫苗接种,包括任何根据州或联邦法律获得额外隐私保护的疫苗接种,均须由我的药房或其业务伙伴报告给免疫登记处,该登记处可能会与他人共享我的免疫数据,并向我的初级保健医生、授权医生或当地卫生部门(如适用)报告,且我授权此类披露。(仅限新泽西州:我授权 ___ 不授权 ___ 向我的初级保健提供者报告我已接种本次疫苗的情况,我理解未勾选授权/不授权将被视为授权。)(仅限南达科他州、缅因州、马萨诸塞州和新罕布什尔州:我理解我有权反对通过此类登记处与上述各方共享我的数据。)。对于未成年人的父母或监护人,以下同意书确认已收到每年拜访儿科医生的书面通知。
Hansoh Pharmaceutical Group Company Limited翰森制药...
2024年8月20日,GSK宣布,FDA授予BTD为GSK'227授予了广泛的小细胞肺癌(“ ES-SCLC”)患者,该患者在基于铂的化学疗法后或之后具有疾病进展的患者(复发或折磨)。2024年11月1日,中国国家医疗产品管理局将HS-20093列为突破性治疗指定的药物,拟议的指示表明在标准一线治疗后开发了ES-SCLC(Platinum Doublet Chemoperation(Platinum Doublet Chemoperation)结合使用,结合了免疫治疗)。2024年12月16日,GSK宣布欧洲药品局(EMA)授予GSK'227的优先药品(Prime)指定,用于治疗复发性ES-SCLC患者。
食品和饮料威尔士行业委员会:艾莉森·哈维(Alison Harvey)的更新(2025年2月)|政府wales
我感到非常高兴的是,副第一部长兼内阁秘书气候变化和农村事务,Huw Irranca Davies能够在上次会议上与我们会面,以对他如何希望董事会与威尔士政府合作发表自己的看法。我也对他在董事会上听我们每个人的时间的时间印象深刻,并了解我们每个人对“地区”的挑战。他还讨论了我们如何积极影响这些挑战。重要的是要不批评,而是要进行讨论的解决方案。
奉艾尔森空军基地 (PACAF) 指挥官之命
本出版物实施并扩展了空军指令 32-6005《无人陪伴住房管理》的指导。它进一步描述了现役空军、空军预备役和空军国民警卫队以及艾尔森空军基地所有使用无人陪伴住房 (UH) 的单位(包括根据房主-租户支持协议指定的指定和附属相关单位)的政策和程序。它还提供了授权和处理无受抚养人基本住房津贴 (BAH) 申请的程序。使用 AF 表格 847《出版物变更建议》将建议的变更和有关本出版物的问题提交给上面列出的 OPR;通过适当的指挥链将 AF 表格 847 从现场转发给相应的指挥链。豁免申请必须提交给上面列出的 OPR,或按照本出版物中其他规定提交,以供审议和批准。确保根据本出版物中规定的流程创建的所有记录均按照空军手册 (AFMAN) 33-363《记录管理》进行维护,并按照位于 https://www.my.af.mil/afrims/afrims/afrims/rims.cfm/ 的空军记录信息管理系统 (AFRIMS) 记录处置时间表 (RDS) 进行处置。空军总部 OPR 不授予任何豁免权。本出版物中使用任何特定制造商、商业产品、商品或服务的名称或标记并不意味着空军的认可
通过军队服役获得入籍 - 艾尔森空军基地
E 资格 如果您正在或曾经在美国武装部队服役,并有兴趣成为美国公民,您可能有资格根据《移民和国籍法》 (INA) 的特别规定申请入籍。如果您符合 INA 第 328 或 329 条的所有要求,您可以根据适用于您的条款提交 N-400 表(入籍申请表)申请入籍。您无需支付根据 INA 328 或 329 申请入籍的任何费用。作为美国军队的现役或退役成员,某些其他入籍要求可能不适用于您;例如,如果您在指定的敌对时期光荣服役,您可能不必在申请入籍之前在美国居住或实际在美国停留一段时间。一年兵役 如果您在任何时候在美国武装部队光荣服役至少一年,您可能有资格申请入籍。虽然 INA 328 适用一些一般入籍要求,但其他要求可能不适用或减少。要根据 INA 328 确定资格,您必须:
Hanx Biopharmaceuticals (Wuhan) Co., Ltd. (翰思艾泰生物 ...
最终的[ 删节 ]预期将由我们与[ 删节 ](代表其本身及代表[ 删节 ])就[ 删节 ]达成协议而定。[ 删节 ]预期将于[ 删节 ]或前后生效。除非另有公布,[ 删节 ]将不会超过每[ 删节 ]港元[ 删节 ],而目前预期将不低于每[ 删节 ]港元[ 删节 ]。申请[ 删节 ]的投资者在申请时(视申请渠道而定)可能需要支付最高[ 删节 ],即每[ 删节 ] 港元[ 删节 ],另加1.0%经纪佣金、0.0027%证监会交易征费、0.00015%AFRC交易征费及0.00565%联交所交易费,惟如[ 删节 ]低于每[ 删节 ]港元,则可退还该等费用。如因任何原因,我们与[ 删节 ](为其本身及代表[ 删节 ])未能于[ 删节 ]中午12时正或之前(香港时间)达成[ 删节 ],则[ 删节 ](包括[ 删节 ])将不会进行并会失效。