XiaoMi-AI文件搜索系统
World File Search Systemnivolumab和ipilimumab用于无法切除的恶性间皮瘤:24个月预测与实际分析
使用Kaplan-Meier方法来确定Nivolumab患者的治疗时间。休息时间定义为供应之间中位时间的三倍以上。在数据结束时,一名患者被视为继续治疗(分类为Kaplan-Meier分析)(即2023年11月底)如果他们的上一张处方是在中位数时间的三倍之内,以补给该结束日期。否则,该患者被认为已停止治疗,治疗覆盖范围结束日期是他们上次处方的供应日期以及中位数的补给时间。如果患者的供应距离的差距是中位数时间的三倍以上,则该患者被认为已被重新治疗。
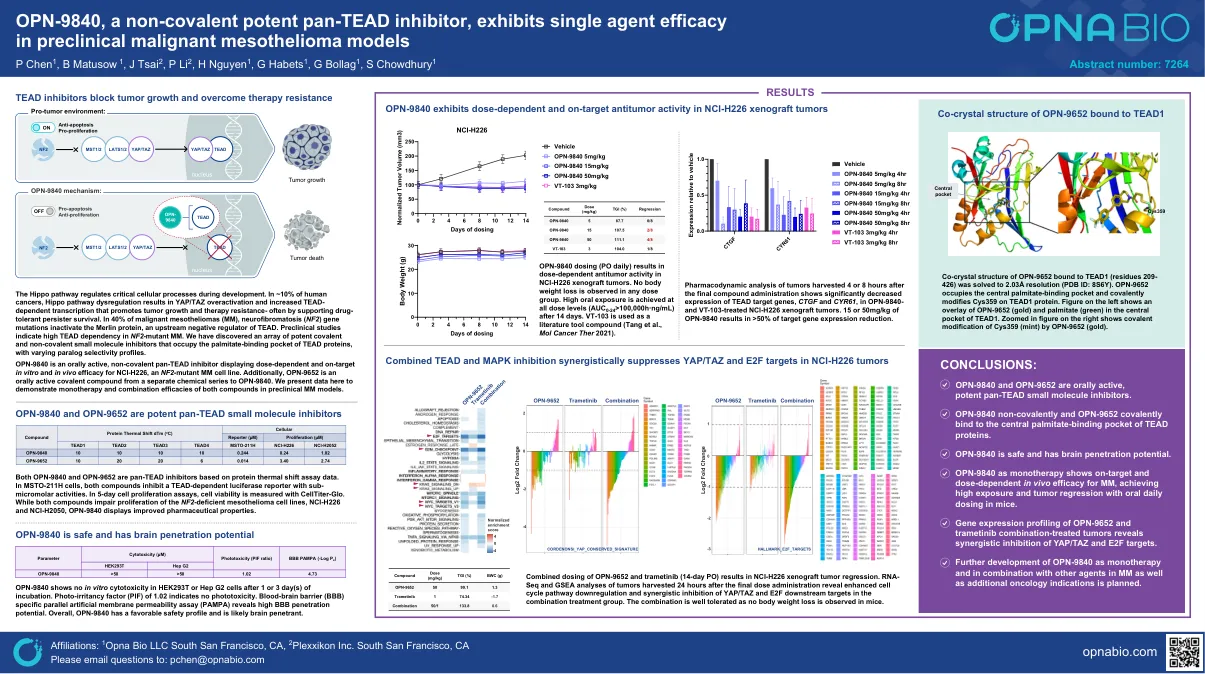
OPN-9840,一种非共价有效的泛胶抑制剂,在临床前恶性间皮瘤模型中表现出单药疗效
河马途径调节发育过程中关键细胞过程。在〜10%的人类癌症中,河马途径失调导致YAP/TAZ过度活化,并增加依赖性转录,从而促进肿瘤生长和耐药性 - 通常通过支持药物耐受性持久性生存。在40%的恶性间皮瘤(MM)中,神经纤维瘤病(NF2)基因突变使Merlin蛋白失活,Merlin蛋白是TEAD的上游负调节剂。临床前研究表明NF2突变MM中的高曲线依赖性。我们发现了一系列有效的共价和非共价小分子抑制剂,这些抑制剂占据了te蛋白的棕榈酸盐结合口袋,具有不同的旁系同源物选择性曲线。
恶性胸膜间皮瘤全身治疗的新靶点
摘要:恶性胸膜间皮瘤 (MPM) 是一种由不同分子和病理亚型组成的异质性癌症。不幸的是,MPM 具有侵袭性,目前针对晚期、不可切除疾病的治疗仍然仅限于细胞毒性化疗和免疫疗法。我们对 MPM 基因组图谱的了解正在稳步增长,而 MPM 中有效靶向疗法的发现进展比其他实体肿瘤慢。鉴于 MPM 中肿瘤抑制基因变异的普遍性,确定可操作的靶点一直具有挑战性。然而,过去十年来,对 MPM 基因特征进行表征的努力已导致一系列新型靶向疗法进入早期临床试验。在这篇综述中,我们讨论了迄今为止 MPM 靶向全身疗法的进展以及晚期 MPM 患者靶向策略的未来方向。
间皮素和临床意义的生物学:现有文献的回顾
自1992年发现以来,间皮素(MSLN)已引起了一种兴趣作为治疗靶标。许多特征使其成为此目的的理想之选。首先,它不在任何重要器官的pa-rechyma上表达。第二,它是在预后相对较差且缺乏有效全身选择的许多癌症类型上差异表达的。第三,它在细胞膜上表达,使其可用于大分子靶向疗法。然而,与其他用于治疗益处的药物靶标不同,MSLN的确切功能,为什么在某些癌症中表达出来,并且其生物学作用尚未明确阐明。在这里审查了有关MSLN类型的MSLN细胞功能和表达模式的现有文献,以进一步了解这一有趣的分子。这样做,我们得出的结论是,它在细胞和肿瘤生物学中的功能和作用仍然存在很大的歧义。此外,MSLN的表达及其对预后的关系似乎对肿瘤的类型产生了影响。最后,MSLN充当传达肿瘤侵袭性的统一机制仍然难以捉摸。很明显,在这个领域中尚未发现很多东西,因此可能对治疗其他致命的恶性肿瘤有很大的影响。
在脑部计算机界面任务期间皮质树突中的矢量化指导性信号
。cc-by-nd 4.0国际许可证(未经同行评审证明)获得的是作者/资助者,他已授予Biorxiv的许可证,以永久显示预印本。这是该版本的版权持有人,该版本发布于2023年11月5日。 https://doi.org/10.1101/2023.11.03.565534 doi:Biorxiv Preprint
研究文章NAV-003,一种针对独特的间皮表位和CD3ε的双特异性抗体,具有改善对体液免疫蛋白酶的细胞毒性
间皮素(MSLN)是多种癌症类型中过表达的细胞表面蛋白。在临床试验中已经测试了几种抗体和基于细胞的MSLN靶向剂,在临床试验中,其治疗疗效充其量是中等的。先前使用抗体和嵌合抗原受体– T细胞(CAR-T)策略的研究表明,特定MSLN表位的重要性是为最佳的治疗反应,而其他研究发现某些MSLN阳性肿瘤可以产生可以产生与IgG1-Type抗体的子集的蛋白质,并抑制其不受欢迎的效果。In an attempt to develop an improved anti-MSLN targeting agent, we engineered a humanized diva- lent anti-MSLN/anti-CD3 ε bispecific antibody that avoids suppressive factors, can target a MSLN epitope proximal to the tumor cell surface, and is capable of effectively binding, activating, and redirecting T cells to the surface of MSLN-positive tumor cells.NAV-003显示,针对在体外和体内产生免疫蛋白的线的肿瘤细胞杀死可显着改善肿瘤细胞。此外,NAV-003在小鼠中表现出良好的耐受性,并且对与人外周血单核细胞共促成的患者衍生的间皮瘤异种移植物具有良好的耐受性。这些数据共同支持了表达MSLN癌症患者的NAV-003临床发展和概念验证研究的潜力。
在可溶性间皮素的存在下具有对高间皮素表达细胞和活性的选择性的工程T细胞参与者
摘要间皮素(MSLN)是一个有吸引力的免疫肿瘤靶标,但是涉及MSLN靶向疗法的发展受到可溶性MSLN(SMSLN)的肿瘤脱落,target的抗肿瘤肿瘤,肿瘤外活性和免疫抑制性肿瘤微环境的阻碍。我们试图设计一种基于抗体的MSLN靶向T细胞参与者(αMSLN/αCD3),具有增强的能力,可以区分高MSLN表达MSLN的肿瘤与正常组织,并在SMSLN存在下活性。我们还单独研究了该分子(NM28-2746)的体内抗肿瘤功效,并与多功能检查点抑制剂/T细胞共激活器NM21-1480(αPD-L1/α4-1BB)结合使用。细胞毒性和由NM28-2746诱导的T细胞激活在外周血单核细胞的共培养中进行了研究,并且在包括可溶性MSLN的情况下表现出不同水平的MSLN表达。人类胰腺癌的异种移植模型用于研究单独的NM28-2746诱导的肿瘤生长的抑制和刺激T细胞浸润对肿瘤的刺激,并与NM21-1480结合使用。二价αMSLNT细胞参与者NM28-2746有效诱导了T细胞激活和T细胞介导的高表达细胞的T细胞介导的细胞毒性,但针对低表达MSLN的细胞的效力要低得多。NM28-2746的单价对应物具有较低的能力,可以区分高MSLN与低MSLN表达细胞的能力。在高浓度的SMSLN存在下,二价分子保留了这种判别能力。在异种移植模型中,NM28-2746表现出明显的肿瘤抑制活性,通过与NM21-1480的联合疗法可以显着增强。NM28-2746,单独或与NM21-1480结合使用,可能会克服先前针对MSLN靶向的免疫肿瘤药物的缺点,在SMSLN存在下表现出对高MSLN表达细胞活性的增强。
nav-001,一种高效率抗体 - 药物结合物,靶向间皮素,通过抵消MUC16/CA125抑制作用
肿瘤生产的细胞表面和分泌蛋白的子集可以与IgG 1型抗体IES结合并抑制其免疫效应活性。由于它们影响抗体和补体介导的免疫力,我们称这些蛋白质体液免疫肿瘤(HIO)因子。抗体药物结合物(ADC)使用抗体靶向结合细胞表面抗原,内部ize进入细胞,然后在释放细胞毒性有效载荷后杀死靶细胞。通过HIO因子对ADC抗体成分的结合由于内在化降低而可能会妨碍ADC的功效。 为了确定HIO因子ADC抑制的潜在影响,我们评估了Hio-fractory,间皮素指导的ADC(NAV-001)和HIO结合的间皮素定向ADC(SS1)的功效。 HIO因子MUC16/CA125与SS1 ADC结合对内在化和肿瘤细胞杀死具有负面影响。 MUC16/CA125难治性NAV-001 ADC显示出在单个,sub-mg/kg剂量下在体外和体内表达MUC16/CA125的MUC16/CA125和非表达肿瘤细胞。 此外,包含PNU-159682拓扑异构酶II抑制作用的NAV-001-PNU在体外和体内表现出良好的稳定性,以及在体内的强大旁观者活性,同时保持体内可耐受性的安全性。 单剂量NAV-001-PNU表明,无论MUC16/CA125表达如何,来自不同肿瘤类型的许多患者衍生的异种移植物都具有稳健的肿瘤回归。由于内在化降低而可能会妨碍ADC的功效。为了确定HIO因子ADC抑制的潜在影响,我们评估了Hio-fractory,间皮素指导的ADC(NAV-001)和HIO结合的间皮素定向ADC(SS1)的功效。HIO因子MUC16/CA125与SS1 ADC结合对内在化和肿瘤细胞杀死具有负面影响。MUC16/CA125难治性NAV-001 ADC显示出在单个,sub-mg/kg剂量下在体外和体内表达MUC16/CA125的MUC16/CA125和非表达肿瘤细胞。此外,包含PNU-159682拓扑异构酶II抑制作用的NAV-001-PNU在体外和体内表现出良好的稳定性,以及在体内的强大旁观者活性,同时保持体内可耐受性的安全性。单剂量NAV-001-PNU表明,无论MUC16/CA125表达如何,来自不同肿瘤类型的许多患者衍生的异种移植物都具有稳健的肿瘤回归。这些发现表明,如NAV-001所观察到的ADC格式使用的硬性抗疗法抗体可能会提高治疗疗效,并保证NAV-001-PNU对人类临床试验的发展作为一种单疗疗法,以治疗中皮蛋白蛋白 - 阳性癌症。
低水平的自愿输入可增强健康年轻人踝关节背屈神经肌肉电刺激期间皮质脊髓的兴奋性
先前的证据表明,当产生的总力量大于每次单一干预时,神经肌肉电刺激 (NMES) 和随意肌肉收缩相结合的干预措施可能对皮质脊髓兴奋性产生更好的影响。然而,目前还不清楚当产生的力量在干预之间匹配时是否存在更好的效果。十个身体健全的个体在不同的日子进行了三次干预:(i) NMES - 胫骨前肌 (TA) 刺激;(ii) NMES+VOL - TA 刺激结合随意踝关节背屈;(iii) VOL - 随意踝关节背屈。每次干预都以相同的总输出施加,即最大力量的 20%,并间歇性地(5 秒开/19 秒关)施加 16 分钟。评估右侧踝关节和比目鱼肌的运动诱发电位 (MEP) 以及腓总神经的最大运动反应 (M max ):每次干预前、干预中和干预后 30 分钟。此外,在每次干预之前和之后评估踝背屈力匹配任务。因此,在 NMES+VOL 和 VOL 会话期间,踝关节 MEP/M max 在干预开始后立即得到显著促进,直到干预结束。与 NMES 相比,在 NMES+VOL 和 VOL 会话期间观察到更大的促进,但它们之间没有差异。运动控制不受任何干预的影响。虽然与单独的自愿收缩相比,没有显示出更好的综合效果,但与单独的 NMES 相比,低水平的自愿收缩与 NMES 相结合可促进皮质脊髓兴奋性。这表明,即使在低水平收缩期间,自愿驱动也可以改善 NMES 的效果,即使运动控制不受影响。