XiaoMi-AI文件搜索系统
World File Search System宿主限制因子 APOBEC3 在人类病毒基因组上的足迹
APOBEC3 酶是先天免疫效应物,可将突变引入病毒基因组。这些酶是胞嘧啶脱氨酶,可将胞嘧啶转化为尿嘧啶。它们优先突变胞嘧啶,然后突变胸腺嘧啶,使 5'TC 基序成为它们的首选目标。病毒已经进化出不同的策略来逃避 APOBEC3 的限制。某些病毒会主动编码对抗 APOBEC3 的病毒蛋白,而另一些病毒则会被动面对 APOBEC3 的选择压力,因为 APOBEC3 靶向基序的基因组已经耗尽。因此,APOBEC3 在某些病毒的基因组上留下了进化的足迹。我们研究的目的是识别这些具有由 APOBEC3 塑造的基因组的病毒。我们分析了 33,400 种人类病毒的基因组,以了解 APO-BEC3 青睐的基序是否耗尽。我们证明 APOBEC3 选择压力影响至少 22% 的目前已注释的所有人类病毒物种。乳头瘤病毒科和多瘤病毒科是足迹最密集的家族;证明选择压力作用于全基因组和两条链。细小病毒科成员在足迹的大小和定位方面具有不同的目标。有趣的是,B19 红细小病毒的两条链上都存在大量 APOBEC3 足迹;这使得该病毒基因组成为 APOBEC3 青睐基序最干净的序列之一。我们还发现地方性冠状病毒科具有显著的足迹。有趣的是,在人畜共患的 MERS-CoV、SARS-CoV-1 和 SARS-CoV-2 冠状病毒上未检测到这样的足迹。除了全基因组足迹的病毒外,某些病毒仅在其基因组的很短部分上留下足迹。这种情况对于γ-疱疹病毒科和腺病毒科来说就是如此,它们的足迹位于裂解性复制起点上。在逆转录的 HIV- 1、HIV-2、HTLV-1 和 HBV 病毒的负链上也可以检测到轻微的足迹。总之,我们的数据说明了 APOBEC3 对人类病毒的选择压力程度,并确定了新的假定 APOBEC3 靶向病毒。
干扰素刺激基因的过度表达筛选确定 RARRES3 是弓形虫感染的限制因子
摘要 弓形虫是一种重要的人类病原体,全球约有三分之一的人感染该病。细胞因子干扰素γ (IFNγ) 在感染过程中被诱导,对于限制人体细胞中的弓形虫生长至关重要。生长限制被认为是由于干扰素刺激基因 (ISG) 的诱导所致,这些基因被上调以保护宿主免受感染。尽管 IFNγ 可诱导数百种 ISG,但它们在限制人体细胞中寄生虫生长方面各自的作用仍然有些难以捉摸。为了解决这一缺陷,我们筛选了 414 个 IFNγ 诱导的 ISG 库,以确定影响人体细胞中弓形虫感染的因子。除了可能通过诱导大量下游基因发挥作用的 IRF1 之外,我们还发现 RARRES3 是限制多种人体细胞系中弓形虫过早逸出而产生的单一因子。总体而言,虽然我们成功鉴定出一种新的 IFNγ 诱导的可限制弓形虫感染的因子,但单独表达时能够限制弓形虫感染的 ISG 数量有限,这表明 IFNγ 介导的对弓形虫感染的免疫是一个复杂的、多因素的过程。
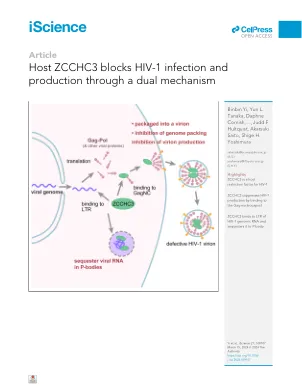
主机ZCCHC3通过双重机制阻止了HIV-1感染和生产
总结大多数哺乳动物细胞通过表达激活免疫系统的各种限制因子和传感器来防止病毒感染和增殖。已经鉴定出抑制人类免疫缺陷病毒1型(HIV-1)的几种宿主限制因子,但大多数人都被病毒蛋白拮抗。在这里,我们以CCHC型锌 - 纤维纤维蛋白3(ZCCHC3)为抑制HIV-1和其他逆转录病毒的产生的新型HIV-1限制性FACER,但似乎并未被病毒蛋白直接拮抗。它通过通过锌 - 纤维基序与GAG Nucleocapsid(GAGNC)结合起作用,该基序抑制了病毒基因组募集并导致基因组较高的病毒体产生。ZCCHC3还通过中间折叠结构域与病毒基因组上的长时间重复结合,将病毒基因组隔离为P体,从而导致病毒复制和产生减少。这种独特的双作用抗病毒机制构成了ZCCHC3的上调,这是一种新型的潜在治疗策略。
开发新型EIF4E抑制剂可有效,有选择地抑制多种指示的肿瘤生长
尽管在治疗癌症方面取得了很大进展,但耐药性仍然是患者治愈的主要障碍。打击耐药性的一种策略是疗法的结合,与正确的配对可以增强抗肿瘤功效,并降低发展抗性的可能性。真核翻译起始因子4E(EIF4E)是蛋白质合成的主要调节剂和速率限制因子,是与其他认可的疗法相结合的有希望的靶标,因为它是多个致癌信号途径的关键调节节点的位置。此外,EIF4E通过许多耐药机制重新激活,以促进多种亲核因子的翻译,包括细胞周期蛋白D1/3,使其成为增强靶向疗法的抗癌活性并克服耐药性的有吸引力的靶标。在这里,我们介绍了在多个肿瘤适应症中使用的新型,有效和选择性EIF4E抑制剂的开发。
执行摘要
概述 OyaGen 起源于影响细胞和病毒基因读数的基因编辑酶科学,由罗彻斯特大学 Harold C. Smith 博士(纽约州罗彻斯特市) ( https://haroldsmithlab.com ) 开展学术工作。OyaGen, Inc. 由 Smith 博士于 2003 年创立,拥有托马斯杰斐逊大学授权的独家知识产权 (IP) 以及公司药物靶点和抗病毒先导化合物平台上的众多自生 IP。2008 年,OyaGen 开始基于新颖的病毒药物靶点和方法开展针对 HIV 的口服抗病毒化合物药物研发工作,这使公司的方法在制药领域中脱颖而出。我们是唯一一家利用 HIV Vif 蛋白进行药物开发的商业公司,从而通过宿主细胞限制因子实现天然(先天)免疫,从而有效中和所有 HIV 进化枝和毒株。正在开发的先导化合物已经过测试,并被联邦政府 (NIAID) 认定为具有作为一流候选药物的潜力。此外,该公司还拥有一项平台技术,该技术已实现对 SARS-CoV2、MERS、埃博拉、拉沙病毒和痘病毒的先进先出鉴定,这些病毒在之前的癌症临床试验和临床前动物研究中已证实对人类受试者具有安全性。此外,OyaGen 不断创新,并积极开发针对多种病毒类别和肿瘤靶点的广谱抗病毒药物的新筛选检测方法。
病毒-宿主相互作用网络作为 IAV 和 SARS-CoV-2 抗病毒药物的新靶点
摘要 当前,SARS-CoV-2尤其是Omicron毒株肆虐全球,甚至与IAV共同感染人类,严重威胁人类公共卫生。目前尚未发现针对SARS-CoV-2的特效抗病毒药物。这需要更深入地了解SARS-CoV-2与宿主相互作用的分子机制,探索抗病毒药物靶点,为研发抗SARS-CoV-2药物提供理论基础。本文讨论了IAV,它已被广泛研究,有望为SARS-CoV-2研究提供除冠状病毒科成员之外最重要的参考价值。我们希望为病毒-宿主相互作用的研究建立理论体系。先前的研究表明,宿主PRR识别IAV或SARS-CoV-2的RNA,然后激活先天免疫信号通路,诱导宿主限制因子(如ISG)的表达,最终抑制病毒复制。同时,病毒也在转录、翻译、翻译后修饰和表观遗传水平上进化出各种对抗宿主先天免疫的调控机制。此外,病毒可以劫持支持宿主的因子进行复制。值得注意的是,宿主抗病毒先天免疫与病毒对抗宿主先天免疫之间的竞争形成了病毒-宿主相互作用网络。此外,病毒复制周期受蛋白质、ncRNA、糖、脂质、激素和无机盐共同调控。鉴于此,我们更新了基于病毒-宿主相互作用网络的抗病毒药物靶点映射,并从病毒免疫学和系统生物学的角度提出了将病毒-宿主相互作用网络作为 IAV 和 SARS-CoV-2 抗病毒药物新靶点的创新思路。
利用 CRISPR-Cas9 核糖核蛋白高效生成同源原代人类髓系细胞
摘要 使用 CRISPR-Cas9 对原代人类细胞进行基因组工程改造彻底改变了细胞生物学的实验和治疗方法,但人类髓系细胞在遗传上仍然难以治疗。我们提出了一种通过核转染将 CRISPR-Cas9 核糖核蛋白 (RNP) 复合物直接递送到从外周血纯化的 CD14+ 人类单核细胞中的方法,从而实现高精确基因敲除率。这些细胞可以有效分化为单核细胞衍生的巨噬细胞或树突状细胞。该过程产生的基因编辑细胞保留了髓系分化和吞噬功能的关键标记。限制因子 SAMHD1 的基因消融使 HIV-1 感染增加了 50 多倍,证明了该系统在基因型-表型查询方面的强大功能。这种快速、灵活且可扩展的平台可用于人类髓系细胞在免疫信号、炎症、癌症免疫学、宿主-病原体相互作用等方面的遗传研究,并可促进新型髓系细胞疗法的开发。简介髓系细胞是健康和疾病免疫系统中的关键参与者(Germic 等人,2019 年;Lapenna 等人,2018 年;Worbs 等人,2017 年)。单核细胞和巨噬细胞在先天免疫系统的直接分支中发挥作用,对病原体或组织损伤作出反应,并帮助调节和解决组织炎症。作为专业的抗原呈递细胞,树突状细胞可协调适应性免疫反应。鉴于髓系细胞的核心作用,髓系细胞被确定为从发育和稳态调节到病原体反应、自身炎症性疾病、纤维化和恶性肿瘤等各个方面的关键参与者也就不足为奇了 (Chao 等人,2020 年;Engblom 等人,2016 年;Manthiram 等人,2017 年;Medzhitov 和 Janeway,2000 年、1997 年;Wynn 等人,2013 年)。更好地了解这些细胞的正常行为和致病行为对于进一步加深我们对各种疾病的机制理解至关重要,为发现和发展新疗法带来了希望。我们识别新治疗靶点和构建新细胞干预措施的能力与我们对相关原代细胞类型的基因操作能力同步发展。例如,小鼠基因方法揭示了小鼠巨噬细胞的显著多样性,而骨髓亚群的基因消融为临床中类似细胞的治疗靶向铺平了道路(Wynn 等人,2013 年)。CRISPR-Cas9 介导的基因靶向显著扩展了曾经难以治疗的细胞类型的潜力,促进了重要的发现工作和增强的原代 T 细胞细胞治疗方法(Roth 等人,2018 年;Schumann 等人,2015 年;Simeonov 和 Marson,2019 年;Stadtmauer 等人,2020 年),以及使用编辑的造血干细胞/祖细胞治疗衰弱性遗传疾病(Foss 等人,2019 年;Wu 等人,2019 年)。到目前为止,CRISPR-Cas9 在原代人类髓系细胞中效率低下,限制了人类免疫系统这些关键细胞的功能遗传学研究和基因组工程。已鉴定出 SAMHD1 是髓系细胞中阻止有效慢病毒转导的关键限制因子(Hrecka 等人,2011 年;Laguette 等人,