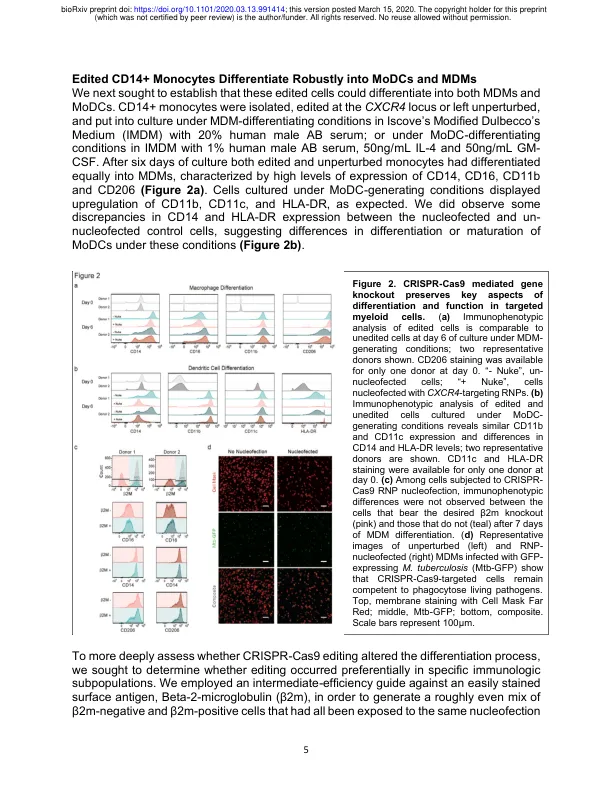
摘要 使用 CRISPR-Cas9 对原代人类细胞进行基因组工程改造彻底改变了细胞生物学的实验和治疗方法,但人类髓系细胞在遗传上仍然难以治疗。我们提出了一种通过核转染将 CRISPR-Cas9 核糖核蛋白 (RNP) 复合物直接递送到从外周血纯化的 CD14+ 人类单核细胞中的方法,从而实现高精确基因敲除率。这些细胞可以有效分化为单核细胞衍生的巨噬细胞或树突状细胞。该过程产生的基因编辑细胞保留了髓系分化和吞噬功能的关键标记。限制因子 SAMHD1 的基因消融使 HIV-1 感染增加了 50 多倍,证明了该系统在基因型-表型查询方面的强大功能。这种快速、灵活且可扩展的平台可用于人类髓系细胞在免疫信号、炎症、癌症免疫学、宿主-病原体相互作用等方面的遗传研究,并可促进新型髓系细胞疗法的开发。简介髓系细胞是健康和疾病免疫系统中的关键参与者(Germic 等人,2019 年;Lapenna 等人,2018 年;Worbs 等人,2017 年)。单核细胞和巨噬细胞在先天免疫系统的直接分支中发挥作用,对病原体或组织损伤作出反应,并帮助调节和解决组织炎症。作为专业的抗原呈递细胞,树突状细胞可协调适应性免疫反应。鉴于髓系细胞的核心作用,髓系细胞被确定为从发育和稳态调节到病原体反应、自身炎症性疾病、纤维化和恶性肿瘤等各个方面的关键参与者也就不足为奇了 (Chao 等人,2020 年;Engblom 等人,2016 年;Manthiram 等人,2017 年;Medzhitov 和 Janeway,2000 年、1997 年;Wynn 等人,2013 年)。更好地了解这些细胞的正常行为和致病行为对于进一步加深我们对各种疾病的机制理解至关重要,为发现和发展新疗法带来了希望。我们识别新治疗靶点和构建新细胞干预措施的能力与我们对相关原代细胞类型的基因操作能力同步发展。例如,小鼠基因方法揭示了小鼠巨噬细胞的显著多样性,而骨髓亚群的基因消融为临床中类似细胞的治疗靶向铺平了道路(Wynn 等人,2013 年)。CRISPR-Cas9 介导的基因靶向显著扩展了曾经难以治疗的细胞类型的潜力,促进了重要的发现工作和增强的原代 T 细胞细胞治疗方法(Roth 等人,2018 年;Schumann 等人,2015 年;Simeonov 和 Marson,2019 年;Stadtmauer 等人,2020 年),以及使用编辑的造血干细胞/祖细胞治疗衰弱性遗传疾病(Foss 等人,2019 年;Wu 等人,2019 年)。到目前为止,CRISPR-Cas9 在原代人类髓系细胞中效率低下,限制了人类免疫系统这些关键细胞的功能遗传学研究和基因组工程。已鉴定出 SAMHD1 是髓系细胞中阻止有效慢病毒转导的关键限制因子(Hrecka 等人,2011 年;Laguette 等人,
利用 CRISPR-Cas9 核糖核蛋白高效生成同源原代人类髓系细胞
主要关键词