XiaoMi-AI文件搜索系统
World File Search System托珠单抗(Actemra®)
1. Actemra 处方信息。Genentech Inc. 12/2022 2. Beukelman T、Patkar NM、Saag KG 等 2011 年美国风湿病学会关于治疗幼年特发性关节炎 (JIA) 的建议。Arthritis Care Res 2011;63(5): 465-482。3. Ringold S、Weiss PF、Beukelman T 等 2013 年更新的 2011 年美国风湿病学会关于治疗幼年特发性关节炎的建议:对全身性幼年特发性关节炎儿童的药物治疗和对接受生物药物治疗的儿童进行结核病筛查的建议。Arthritis Rheum 2013;65:2499-512。4. Singh JA、Saag KG、Bridges SL 等2015 年美国风湿病学会类风湿关节炎治疗指南。关节炎护理研究 2016;68:1-25。
荧光标记的维多珠单抗可用于可视化炎症性肠病中的药物分布和粘膜靶细胞
摘要 目的 改善 IBD 患者选择和生物疗法(如维多珠单抗)的开发需要彻底了解作用机制和靶标结合,从而提供个性化的治疗策略。我们的目的是可视化静脉注射荧光标记的维多珠单抗 vedo-800CW 的宏观和微观分布,并使用荧光分子成像 (FMI) 识别其靶细胞。 设计 进行了 43 次 FMI 程序,包括内窥镜检查期间的宏观体内评估,然后进行宏观和微观体外成像。在 A 期,患者在内窥镜检查前接受 4.5 毫克、15 毫克 vedo-800CW 或无示踪剂的静脉注射。在 B 期,患者接受 15 毫克 vedo-800CW,然后接受未标记的(亚)治疗剂量的维多珠单抗。结果 FMI 定量显示炎症组织中 vedo-800CW 荧光强度呈剂量依赖性增加,15 mg(153.7 au(132.3–163.7))是最适合的示踪剂剂量,而 4.5 mg(55.3 au(33.6–78.2))则为最合适剂量(p=0.0002)。此外,在给予治疗剂量的未标记维多珠单抗后给予 vedo-800CW 时,荧光信号降低了 61%,表明炎症组织中的靶标已饱和。荧光显微镜和免疫染色显示,维多珠单抗渗透到发炎的粘膜中并与几种免疫细胞类型相关,最显著的是与浆细胞相关。结论这些结果表明 FMI 有望确定炎症靶组织中药物的局部分布并识别药物靶细胞,为靶向药物在 IBD 中的应用提供了新的见解。试验注册号 NCT04112212。
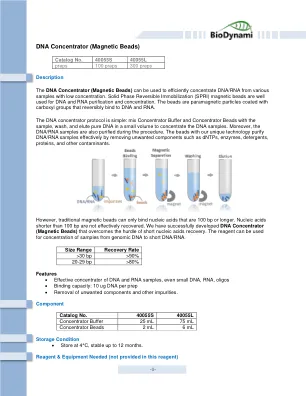
DNA浓缩器(磁珠)
有限的标签许可证该产品是开发和出售的,专门用于研究目的,仅用于体外使用。尚未对产品或其任何单个成分进行测试,用于诊断或药物开发,不适合用于人类或动物。该产品的购买者被授予有限的,不可转让的权利,仅将购买的产品仅用于内部研究目的,以造成购买者的唯一利益。买方不能出售或以其他方式转移(i)本产品(ii)使用此产品或其组件制成的材料或(iii)将其组件或其组件制成的材料或以其他方式使用本产品,其组件或使用此产品或其组件制成的材料或材料出于商业目的。该产品仅用于内部研究目的,不适用于任何形式的商业目的。“Commercial purposes” includes any activity for which a party receives consideration and may include, but is not limited to, (1) use of the product or its components or derivatives in manufacturing, (2) transfer or sale of vectors made with the product or components or derivatives of the product, (3) use of this product or components or derivatives of the product made therefrom to provide a service, information, or data to a third party in return for a fee or other考虑,或(4)转售该产品或其组件或衍生物,无论是该产品或其组件或衍生物是否都转售用于研究中。如果购买者不愿意接受此有限使用声明的局限性,则Biodynami愿意接受全额退款的产品退货。有关获得额外权利的信息,请联系support@biodynami.com Biodynami 601 Genome Way,Huntsville,Alabama,Alabama 35806,美国,https://biodynami.com支持@ biodynami .com .com
媒体与投资者发布
关于 Pagoda 研究 14 Pagoda ( NCT04108156 ) 是一项多中心、随机、主动治疗对照、非劣效性的美国 III 期研究,在 634 名糖尿病性黄斑水肿患者中评估每六个月补充一次 Susvimo®(含雷珠单抗的输液平台)与每月玻璃体内注射 0.5 毫克雷珠单抗的疗效、安全性和药代动力学。参与者按 3:2 随机分配接受每六个月补充一次的 Susvimo 或继续每月玻璃体内注射雷珠单抗。在 Susvimo 组中,参与者在第 16 周植入 Susvimo 之前接受了四次玻璃体内注射雷珠单抗负荷剂量。研究的主要终点是最佳矫正视力评分(一个人在阅读视力表上的字母时可以达到的最佳远距离视力 - 包括佩戴眼镜等矫正)相对于基线在第 60 周和第 64 周的平均变化。在初步分析之后,最初随机接受玻璃体内注射的参与者接受了 Susvimo 治疗,每 24 周补充一次。
帕妥珠单抗-曲妥珠单抗-透明质酸酶-zzxf (Phesgo)
o 作为早期乳腺癌完整治疗方案的一部分,对 HER2 阳性、局部晚期、炎性或早期乳腺癌(直径大于 2 厘米或淋巴结阳性)患者进行新辅助治疗。 o 对复发风险高的 HER2 阳性早期乳腺癌患者进行辅助治疗。 • 与多西他赛联合使用,用于治疗 HER2 阳性转移性乳腺癌 (MBC) 患者,这些患者之前未接受过抗 HER2 治疗或转移性疾病化疗。 政策/标准 提供商必须提交文件(如办公室图表说明、实验室结果或其他临床信息)证明会员已满足所有批准标准。 Centene Corporation ® 附属健康计划的政策是,当满足以下标准时,Phesgo 具有医疗必要性: I. 初步批准标准
在一个维
了解嘈杂的中等规模量子(NISQ)设备的计算能力对于量子信息科学既具有基本和实际重要性。在这里,我们解决了一个问题,即错误误差量子计算机是否可以比古典计算机提供计算优势。特别是,我们在一个维度(或1d Noisy RCS)中研究嘈杂的随机回路采样,作为一个简单的模型,用于探索噪声效应对噪声量子设备的计算能力的影响。特别是,我们通过矩阵产品运算符(MPO)模拟了1D噪声随机量子电路的实时动力学,并通过使用度量标准来表征1D噪声量子系统的计算能力,我们称为MPO Entangrelemt熵。选择后一个度量标准是因为它决定了经典MPO模拟的成本。我们从数值上证明,对于我们考虑的两个QUITAT的错误率,存在一个特征性的系统大小,添加更多量子位并不会带来一维噪声系统的经典MPO模拟成本的指数增长。特别是,我们表明,在特征系统的大小上面,有一个最佳的电路深度,与系统大小无关,其中MPO倾斜度熵是最大化的。最重要的是,最大可实现的MPO纠缠熵是有限的
Apostle MiniEnrich® DNA 纯化珠
图 3. Bioanalyzer 2100 DNA 12000 右侧尺寸选择日期。A1:通过右侧去除步骤去除的 DNA 片段 – 0.5 倍。B1:通过右侧去除步骤去除的 DNA 片段 – 0.6 倍。C1:通过右侧去除步骤去除的 DNA 片段 – 0.7 倍。D1:通过右侧去除步骤去除的 DNA 片段 – 0.8 倍。E1:通过右侧去除步骤去除的 DNA 片段 – 1.0 倍。F1:通过右侧去除步骤去除的 DNA 片段 – 1.4 倍。A2:右侧尺寸选择后回收的 DNA 片段 – 0.5 倍/2.0 倍。B2:右侧尺寸选择后回收的 DNA 片段 – 0.6 倍/1.9 倍。C2:右侧尺寸选择后回收的 DNA 片段 – 0.7 倍/1.8 倍。 D2:右侧尺寸选择后回收的 DNA 片段 — 0.8×/1.7×。E2:右侧尺寸选择后回收的 DNA 片段 — 1.0×/1.5×。F2:右侧尺寸选择后回收的 DNA 片段 — 1.4×/1.1×。
MPS1-阿特珠单抗-组合-...
• NMS-153:一种临床阶段的、强效且高选择性的单极纺锤体 1 (MPS1) 小分子抑制剂和 cGAS/STING 通路激活剂,具有差异化的作用机制和同类首创/同类最佳的潜力 • 该临床试验是针对肝细胞癌的 II 期研究,其中 NMS-153 与免疫检查点抑制剂阿特珠单抗联合使用 意大利内维亚诺,2025 年 1 月 7 日——Nerviano Medical Sciences Srl (NMS) 是一家致力于发现和开发治疗癌症的创新疗法的临床阶段公司,今天宣布已与罗氏公司签订了临床试验供应协议,提供阿特珠单抗 (Tecentriq®) 1 与单极纺锤体 1 (MPS1) 抑制剂 NMS-153 和 cGAS/STING 通路激活剂联合用于治疗肝细胞癌患者。这项新研究最近获得卫生部门批准,名为“NMS- 01940153E 和阿替利珠单抗联合或不联合低剂量地西他滨用于治疗既往接受过免疫检查点抑制剂治疗的不可切除性肝细胞癌 (HCC) 成人患者的 II 期联合研究”(EUCT 编号:2024-516737-12-00)。该试验是一项 IIa 期、开放标签、非随机、两部分多中心研究,旨在探索 NMS-153 与阿替利珠单抗联合用于既往接受过获批免疫检查点抑制剂治疗且已从该治疗中获益的不可切除性 HCC 成人患者的安全性、耐受性和抗肿瘤活性。 NMS 最近完成了单药治疗“NMS- 01940153E 对既往接受过全身治疗的不可切除肝细胞癌 (HCC) 成人患者的安全性和有效性的 I/II 期研究”(NCT05630937),确定了临床活动的早期迹象,具有足够的安全性。“MPS1 抑制已被证明是多种癌症类型(包括肝细胞癌)中 cGAS/STING 通路的强效上游再激活剂。将其与地西他滨联合使用以逆转肿瘤细胞对 STING 的表观遗传沉默,以及 PD-L1 阻断,是一种令人兴奋的新策略,旨在尝试恢复治疗难治性疾病的免疫原性”,Dana-Farber 癌症研究所 Lowe 胸部肿瘤中心主任、哈佛医学院医学副教授、NMS 科学顾问委员会成员 David A. Barbie 医学博士评论道。 NMS 首席执行官 Hugues Dolgos 博士表示:“我们的目标是为肝癌患者提供有效的治疗选择:atezolizumab 是一种已获批用于治疗肝细胞癌的药物,与 NMS-153 联合使用具有巨大潜力,因为每种药物都已显示出临床活性
Perjeta(帕妥珠单抗)
• 作为早期乳腺癌完整治疗方案的一部分,对 HER2 阳性、局部晚期、炎性或早期乳腺癌(直径大于 2 cm 或淋巴结阳性)患者进行新辅助治疗 • 对复发风险高的 HER2 阳性早期乳腺癌患者进行辅助治疗 如果未使用含帕妥珠单抗的方案作为新辅助治疗,美国国家综合癌症网络 (NCCN) 对在辅助治疗中使用 Perjeta 提供了额外建议,其证据级别为 2A,其支持依据是来自转移性疾病参与者的治疗(CLEOPATRA 试验)的证据推断以及新辅助治疗中病理完全缓解的改善。帕妥珠单抗加曲妥珠单抗与紫杉醇的联合治疗是 NCCN 的 2A 类建议。此外,NCCN 建议“对于接受曲妥珠单抗为基础的疗法(不含帕妥珠单抗)治疗后病情进展的患者,可以考虑使用曲妥珠单抗加帕妥珠单抗(含或不含细胞毒性药物(如长春瑞滨或紫杉烷))的疗法”。此外,专业共识意见建议,帕妥珠单抗与曲妥珠单抗和多西他赛或紫杉醇联合使用可作为转移性疾病的单一疗法。NCCN 专家组指出,只要 FDA 指南推荐使用曲妥珠单抗,FDA 批准的生物仿制药就可以替代曲妥珠单抗。目前,多项 2 期临床试验正在评估帕妥珠单抗用于治疗其他实体瘤(例如结直肠癌、头颈癌、神经内分泌肿瘤、非小细胞肺癌、前列腺癌和直肠癌)以及与其他药物和靶向疗法联合使用的效果。然而,这些试验的安全性和有效性数据尚未发表,只有摘要可用(Gupta R 等人 2020 年、Meric-Bernstam F 等人 2019 年、Javie M 等人 2021 年、NCT03225937)。由于临床试验证明了帕妥珠单抗与化疗联合使用的有效性,其他临床试验正在研究将帕妥珠单抗添加到特定靶向生物制剂和/或其他化疗药物中的疗效。然而,目前没有证据支持将帕妥珠单抗与上述未讨论的其他生物制剂联合使用的安全性和有效性。此外,研究人员继续研究抗 HER2 疗法在其他恶性肿瘤中的流行率和作用。然而,目前还没有大规模的随机对照试验来得出关于帕妥珠单抗与乳腺癌以外恶性肿瘤的当前标准疗法相比的安全性和有效性的合理结论。 Perjeta 有黑框警告,警告内容为左心室功能障碍和胚胎-胎儿毒性。Perjeta 可导致亚临床和临床心力衰竭,表现为 LVEF 下降和充血性心力衰竭。接触 Perjeta 可能导致胚胎-胎儿死亡和出生缺陷。告知患者这些风险以及有效避孕的必要性。定义和措施辅助治疗:在主要治疗后给予的治疗,以增加治愈的机会;可能包括化疗、放疗、激素或生物治疗。