XiaoMi-AI文件搜索系统
World File Search System三叶非球面 Janus 的制造及开环控制
简介。不受束缚的微型机器人可以以微创方式输送治疗剂 [1],进入人体其他无法到达的区域 [2, 3]。这些微型机器人在生物医学中的潜在应用非常广泛,从传感 [4-7] 到药物输送 [8-10],甚至再生医学 [11] 等。特别是,微型机器人非常适合再生医学中的细胞应用,因为它们可以快速穿透细胞并实现有效的细胞内输送 [3]。旨在修复受损或患病的组织和器官 [12] 的细胞疗法需要将细胞精确运送到目标位置进行移植 [13, 14]。任何细胞输送失败都可能导致严重的免疫反应 [15]。因此,确保准确、无创地输送细胞至关重要,而微型机器人可以发挥至关重要的作用 [16]。
通过调节局部曲率实现无像差非球面平面可调液体透镜
驱动机制包括气动/流体动力压力、24 电润湿 (EW)、14,21,25 - 27 介电泳 (DEP)、19,28 - 31 等。其中,DEP 方法利用电场,由于其体积小、易于制造和静态液体流动(即无需连续供应液体)等独特优点,有利于芯片实验室集成。它还能够快速响应(约 1 毫秒)并具有焦距的宽可调性(例如,从负到无穷大再到正)。32,33 此外,电驱动液体透镜通常具有高可靠性和长寿命,因为它们不需要机械运动部件。在已报道的可调液体透镜中,它们中的大多数操纵界面的整体曲率并保持球面形状。8,34因此,球面像差变得不可避免,导致成像质量差。在平面液体透镜中,周边光线和近轴光线的焦距差异会导致纵向球面像差 (LSA)。在传统的大型光学系统中,像差由多透镜系统补偿。但在微流控芯片中,很难精确控制多个单独的透镜。因此,操纵局部曲率是实现无像差系统的可行方法。已经提出了各种机制来实现平面外非球面光流控透镜。35 一种简单直接的方法是使用预成型膜 36 – 38 或非圆形孔径 39 来调节液体透镜的非球面性。其中,静电力的使用已被证明
基于不同微结构的反射特性可调微镜阵列及其应用
摘要:传统的反射特性可调的反射式光学表面需要复杂的外部电源,电源系统结构和制备工艺复杂,导致反射特性的调制有限,难以大规模应用。受生物复眼的启发,利用不同的微结构来调制光学性能。凸非球面微镜阵列(MMA)可以在扩大视场角的同时提高亮度增益,亮度增益广角>90°,视场广角接近180°,具有大增益广角和大视场广角的反射特性。凹非球面微镜阵列可以使亮度增益增加较大量,最高可达2.66,具有高增益的反射特性。并进行了工业级生产和在投影显示领域实际应用。结果证实,凸面MMA能够在宽光谱和宽角度范围内实现亮度增益,而凹面MMA能够显著提高亮度增益,这可能为开发先进的反射光学表面提供新的机遇。
使用光子连接和包装多核纤维...
“具有蛾类抗反省结构的3D打印非球面”,(2024)Y. Mizuno等,Proc。SPIE 12898,用于微型/纳米光学和光子学的高级制造技术XVII,128980R
技术项目
5 轴或 6 轴 CNC 机器(通常称为“箱式机器”)与子孔径抛光技术(例如计算机控制光学表面处理 (CCOS)、磁流变抛光 (MRF) 和离子束定形 (IBF))结合使用,代表了在非球面和自由曲面光学元件制造中实现亚纳米精度的成熟方法。尽管这些方法有效,但它们的特点是财务负担较大,特别是在大规模生产高端光学元件的情况下。本演讲介绍了一种以机器人系统为中心的新型抛光方法。具体而言,确定性抛光技术(例如 CCOS 和 MRF)与机器人平台协同集成,以实现多功能且经济可行的多轴抛光设备。本演讲深入探讨了机器人 CCOS 和 MRF 系统固有的优点和缺点,阐明了旨在提高机器人抛光过程精度的各种补偿技术。经验证据强调了基于机器人的 CCOS 和 MRF 系统在制造中型非球面或自由曲面光学元件时达到纳米级精度的能力,同时在具有成本效益的框架内运行。
曲面 CMOS 成像传感器:开发和可靠性测试结果
与目前的平面传感器相比,曲面成像传感器可显著减小成像系统的尺寸、重量和成本,同时减轻离轴光学像差。在过去二十年中,解锁这些关键功能引起了主要参与者的兴趣。SILINA 一直在开发一种可适应各种传感器特性的 CMOS 图像传感器弯曲工艺。该工艺使图像传感器能够变形为各种形状,从而最大限度地提高每个成像系统的性能。事实上,曲面 CMOS 图像传感器 (CIS) 有助于制造紧凑型光学仪器,尤其是成像仪、望远镜和光谱仪。简化光学系统可以将光机约束从设计阶段释放到集成阶段。如今,自由曲面光学元件参与了满足紧凑、快速、广角和高分辨率系统共同需求的解决方案的开发。然而,自由曲面在制造和计量方面仍然极其昂贵。此外,场曲像差仍然难以校正,而曲面 CIS 则为此提供了合适的解决方案。2021 年初,SILINA 展示了球面和非球面 CIS 的制造,为光学系统设计开辟了新领域。光学设计师现在可以考虑各种传感器形状,通过考虑球面、非球面或更复杂的焦面来优化他们的系统。
AE6357 教学大纲
• 线性无偏最小方差估计技术的开发和应用• 处理轨道物体上的扰动力,例如阻力、辐射压力、非球面重力等。• 了解时间和参考系统对精确轨道测定的重要性• 回顾目前用于跟踪近地和深空环境中物体的各种跟踪方法,例如 GNSS、激光测距、光学、DSN 等。• 了解这些跟踪系统使用的各种物理测量,以及如何处理它们以生成航天器位置和速度估计• 使用模拟和真实数据集进行实践练习• 了解卫星轨道测定的广泛应用和用途,以及课程材料如何应用于地球和行星任务、空间领域感知等。
资产阶级接触结构:紧密性、可填充性和应用
摘要 给定流形 V 上的接触结构及其支持的开卷分解,Bourgeois 给出了 V × T 2 上接触结构的显式构造。我们证明所有这样的结构在 5 维上都是普遍紧的,而与原始接触流形本身是紧的还是过度扭曲的无关。在任意维度上,我们提供了 Bourgeois 流形强辛填充的存在性障碍。这给出了一类弱但不强可填充接触 5 流形的新例子,以及所有奇数维中弱但不强可填充接触结构的第一个例子。这些障碍是 S 1 不变接触流形的更一般障碍的特殊例子。我们还得到了任意维度上的分类结果,即 n 环面的单位余切丛具有唯一的辛非球面强填充直到微分同胚。
密码应变相关光图案发生器
虽然这些技术可以在调制光束中实现高空间分辨率以及生成静态和动态光模式,但它们通常需要高度复杂的光学元件。这最近将注意力转向了折射自由曲面光学元件,它可以通过简单而坚固的装置将光源的强度分布重新分配为任意预定模式,其中至少一个表面相对于垂直于元件主平面的轴没有平移或旋转对称性。[10] 自由曲面光学元件的表面可以精确设计以产生所需的强度模式,[11] 将所涉及的几何形状定义为球面或非球面透镜的总和,或通过 Q 多项式描述和非线性偏微分方程。[10,12] 该方法的优点包括相关系统小型化、视场更宽和成像分辨率更高。 [2,13,14] 通常需要多种制造技术,包括磨削、抛光和超精密车削,[15,16] 这些技术非常耗时、成本高、通用性差,因此无法快速实现自由曲面光学系统,也无法通过外部门改变其特性。 3D 打印技术可以提供替代的制造方法,可以生成具有前所未有复杂几何形状的物体。[17–19] 3D 打印包含多种工艺,可使用不同材料制造非常规结构。[20–22] 在光学和光电子领域,增材制造已经用于生产非球面透镜、微光学元件、波导、光子晶体、发光二极管 (LED)、探测器和传感器。 [19,23,24] 尽管 3D 打印具有光学质量和亚微米分辨率的宏观物体仍然具有挑战性,[25] 但已经提出了许多方法来提高可实现的精度、打印速度和打印物体的尺寸。[26–28] 重要的是,一些应用可能会利用从质量较低的表面生成的光图案,利用 3D 打印技术提供的设计灵活性和定制性。一个相关的例子是加密标签,[29,30] 人们非常希望能够用肉眼或低成本扫描仪识别生成的光图案,而无需笨重的光学元件和复杂的光学系统。[31,32]
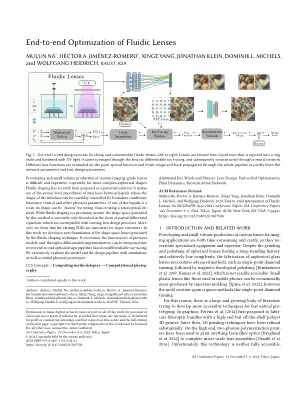
流体镜头的端到端优化
定制成像级镜头的原型制作和少量生产是困难且昂贵的,尤其是对于更复杂的非球面形状而言。流体形状最近被提议作为一种潜在的解决方案:它利用液体之间界面的原子水平平滑度,其中界面的形状可以通过边界条件,浮力控制和其他物理参数仔细控制。如果一种液体是树脂,则可以通过固化来“冷冻”其形状,从而产生固体光学元素。虽然流体形状是一个有前途的途径,但该方法产生的形状空间目前仅以偏微分方程的形式描述,这些方程与现有镜头设计过程不相容。更重要的是,我们证明现有的PDE不准确,不准确。在这项工作中,我们开发了由流体成型技术产生的形状太空镜片的新表述。它克服了以前模型的不准确性,通过可区分的实现,可以基于可区分的射线跟踪将最新的端到端光学设计管道集成到最新的端到端光学设计管道中。我们通过模拟以及初始物理原型广泛评估模型和设计管道。