XiaoMi-AI文件搜索系统
World File Search SystemJinko Ess产品路线图
►第5节:预组装电池系统本节与您将要出售和安装的大部分电池有关。平均电池是“预组装”的,因为它在带有直流输出的外壳内。然后将直流输出连接到带有电池输入的逆变器
CEC批准的 - batteries-2023-12-21.pdf
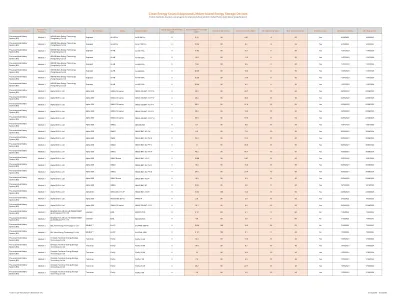
预组装电池系统(BS)方法3 Solax Power网络技术(ZHE Jiang)Co Ltd Solax Power T-Bat-Sys-HV-S3.6 T-Bat HS25.2 0 25.08 90 23.2 0 53 Yes 53 Yes 8/09/09/2023 8/09/2026/2026
组装说明 Goodwin 沙发 Charcoal_Final 20240702(1).ai
目录................................................................2 安全信息......................................................................2 保修..............................................................................3 1 年保修..............................................................................3 保修范围...............................................................................3 保修范围外的内容...................................................................3 预组装........................................................................4 规划组装.........................................................................................4 所需工具.........................................................................................4 随附硬件.........................................................................................4
可持续能源(存储)R2 -2 2025年1月2日
1。它不得标记测试环境2。它不得泄漏3。它必须自给自足,并且能够在主管提供的量表II上进行权衡。电池中溶液的总摩尔度由主管提供的蒸馏白醋或盐水提供,而不受参与者的材料III的故意影响。电池必须在输出线之间具有最大电压电势。f。电池输出可以通过物理更改(电解质的浓度,大小,形状以及阴极或阳极等方向等)来修改。或电子方式(串联或平行的连接单元格)g。不允许预组装电路板。参与者必须能够证明不存在预组装电路板,包括如果需要拆卸设备。h。该设备可能包括被动电子组件,例如:电阻器,电容器,开关等。集成电路,降压/升压转换器,活动组件等。不允许。
预组装 Cas9 核糖核蛋白介导的基因缺失鉴定了灰盖菇中的碳分解代谢阻遏物及其靶基因
摘要 Cre1 是一种重要的转录因子,可调节碳分解代谢抑制 (CCR),在真菌中广泛保守。cre1 基因已在几种子囊菌中得到广泛研究,而其在担子菌物种中基因表达调控的作用仍不太清楚。在这里,我们鉴定了 Coprinopsis cinerea 并研究了 cre1 的作用,Coprinopsis cinerea 是一种可以有效降解木质纤维素植物废物的担子菌模型蘑菇。我们使用一种基于 PCR 扩增的分裂标记 DNA 盒以及体外组装的 Cas9 引导 RNA 核糖核蛋白 (Cas9 RNPs) 的快速有效的基因缺失方法来生成 C. cinerea cre1 基因缺失菌株。两个独立的 C. cinerea cre1 突变体的基因表达谱显示碳水化合物代谢、植物细胞壁降解酶 (PCWDE)、质膜转运蛋白相关基因和几种转录因子编码基因等显著失调。我们的研究结果支持以下观点:与子囊菌中的报告一样,C. cinerea 的 Cre1 通过多种基因的联合调节来协调 CCR,包括 PCWDE、正向调节 PCWDE 的转录因子和可以导入可诱导 PWCDE 表达的单糖的膜转运蛋白。有些矛盾的是,虽然与其他伞菌一致,但与木质素降解相关的基因在 cre1 突变体中大多下调,表明它们受到的调节与其他 PCWDE 不同。基因缺失方法和此处提供的数据将扩展我们对担子菌中 CCR 的了解,并为与植物生物质降解相关的基因提供功能假设。
阳光电源储能系统参考
4 小时液冷储能系统采用预组装和易于安装的设计,电池工作环境更加高效,大大降低了容量损失率,从而大幅降低了资本和运营成本。同时,直流耦合设计更加精简,不需要额外的电源转换系统 (PCS) 和中压站,从而为项目节省了成本。
Double-See® - gruntechnology.com
Double-See 安装快捷方便。所有配件均采用齐平托架和密封装置,配件外部预先标记了插座深度。现场切割管道时,内管和外管切割成相同长度。这些特点使 Double-See 的规划、测量和安装变得简单。此外,所有 Double-See 配件均在工厂预组装。市场上其他一些双密封管道系统要求安装人员在托架配件和接头之间用溶剂粘合额外的接头,这需要更多现场时间并增加泄漏风险。
Double-See 系统宣传册
Double-See 安装快捷方便。所有配件均采用齐平托架和密封装置,配件外部预先标记了插座深度。现场切割管道时,内管和外管切割成相同长度。这些特点使 Double-See 的规划、测量和安装变得简单。此外,所有 Double-See 配件均在工厂预组装。市场上其他一些双密封管道系统要求安装人员在托架配件和接头之间用溶剂粘合额外的接头,这需要更多现场时间并增加泄漏风险。
ES-500500NA
特点 • 20 英尺集装箱设计,配备电池、PCS、HVAC、灭火系统和本地控制器 • 采用最安全的锂电池化学类型 (LiFePO4) 和智能三级电池管理系统,实现最大安全性 • 经过 UL 9540A 测试并通过 UL 9540 认证 • 性能卓越,使用寿命长,1C 下循环超过 5000 次 • 双向 PCS 具有多种模式,可灵活充电和放电 • 95% 预组装交付 • 针对并网和离网应用进行了优化 • 集成本地控制器,用于运行状态控制、直流电网连接控制、保护和数据交换