XiaoMi-AI文件搜索系统
World File Search System儿童和成人纤维瘤病的临床试验:系统评价
1. 世界卫生组织肿瘤分类编辑委员会,《软组织和骨肿瘤》,世界卫生组织肿瘤分类,第 5 版,世卫组织出版社;2020,3。2. Häyry P、Scheinin TM。纤维瘤(Reitamo)综合征:病因、表现、发病机制和治疗。Curr Probl Surg。1988;25(4):233-320。3. van Broekhoven DL、Grünhagen DJ、den Bakker MA、van Dalen T、Verhoef C。腹部外和腹部侵袭性纤维瘤病发病率和治疗的时间趋势:一项基于人群的研究。Ann Surg Oncol。2015;22(9):2817-2823。4. Reitamo JJ、Scheinin TM、Hayry P。纤维瘤综合征。纤维瘤病因、发病机制和治疗的新进展。Am J Surg 。1986;151(2):230-237。5. Orbach D、Brennan B、Bisogno G 等人。EpSSG NRSTS 2005 儿童纤维瘤病治疗方案:国际前瞻性病例系列。Lancet Child Adolesc Health 。2017;1(4):284-292。6. Alman B、Attia S、Baumgarten C 等人。纤维瘤的治疗:针对成人和儿童患者的全球联合共识指南。Eur J Cancer 。2020;127:96-107。
组织的血管化策略的研究进度 -
由骨折,骨肿瘤,感染和其他原因引起的骨缺损不仅是临床治疗中的问题点,而且是当前研究中的热门问题之一。骨组织工程的发展提供了一种修复骨缺损的新方法。许多动物实验性和上升的临床应用研究都表明了它们的出色应用前景。组织工程骨的快速血管化的构建是修复骨缺损的主要瓶颈和关键因素。生物材料植入后尽早建立血管网络可以提供足够的营养和运输代谢物。如果局部血管网络的缓慢形成导致缺乏血液供应,则成骨过程将被延迟甚至无法形成新骨。研究人员通过改变脚手架材料的物理和化学性质,加载生长因子持续释放系统,并将其与微量元素结合,从而在诱发骨骼再生过程中促进早期血管生成,从而对骨骼再生进行早期的血管生成,从而对骨骼的早期生成,这是对整个骨骼再生过程的好处。本文回顾了骨缺损修复过程中局部血管微环境,以及改善脚手架材料和促进血管化的当前方法。
使用光谱光谱和定量超声检查的癌症表征:肉瘤亚型的实体研究
组织学分析是癌症诊断的黄金标准方法。但是,它容易出现主观性和采样偏差。应对这些局限性,我们引入了一种定量的双峰方法,旨在为可疑区域提供非侵入性指导。将光谱光谱和定量超声技术组合在一起,以表征来自动物模型的两种不同的骨肿瘤类型:软骨肉瘤和骨肉瘤。使用两种不同的细胞系诱导骨肉瘤的生长。进行组织学分析作为参考。光反射率的三个超声参数和强度显示,在5%水平上,软骨肉瘤和骨肉瘤之间存在显着差异。同样,尽管在组织学检查中观察到了两种类型的骨肉瘤,但两种类型的骨肉瘤的变化也被报道了两种类型的骨肉瘤。这些观察结果表明我们技术在探测细组织特性中的敏感性。其次,超声基于光谱的技术鉴定了软骨肉瘤细胞和核的平均大小,相对误差分别为22%和9%。光学当量技术正确提取了软骨肉瘤和骨肉瘤的细胞和细胞的散射尺寸分布(分别为9.5±2.6和µ)。软骨肉瘤的核的光散射贡献估计为52%,骨肉瘤的光散射贡献可能分别表明大量和不存在细胞外基质。因此,超声和光学方法带来了互补参数。他们在细胞和核尺度上成功估计了形态学参数,这使我们的双峰技术有望用于肿瘤表征。
分析高压氧气后成骨细胞中单链DNA损伤
摘要:(1)背景:高压氧(HBO)暴露会诱导可能导致DNA损伤的氧化应激,在人外周血血液淋巴细胞或非人类细胞中已经观察到了DNA损伤。在这里,我们研究了高压条件对两个人类成骨细胞系的影响:原代人成骨细胞,HOB和成骨肿瘤细胞系SAOS-2。(2)方法:在实验性高压腔(4 ATA,100%氧,37℃和4 H)或假暴露(1 ATA,空气,37℃和4小时)中,将细胞暴露于HBO。DNA损伤在暴露于碱性彗星测定后直接,在暴露后24小时检查,并检测γH2AX+53BP1共定位双链断裂(DSB)灶和细胞凋亡。用QRT-PCR测量了参与抗氧化功能的TGFß-1,HO-1和NQO1的基因表达。(3)结果:碱性彗星测定法显示HBO 4小时后两个细胞系的DNA损伤水平显着升高,而DSB焦点类似于假。γH2AX分析表明,这两种细胞系的凋亡都略有增加。暴露后HO-1在HOB和SAOS-2中的表达增加表明在这些细胞中诱导了抗氧化反应。此外,暴露后4小时,在HOB细胞中TGF-ß1的表达受到负面影响。(4)结论:总而言之,这项研究表明成骨细胞对高压高氧的DNA损伤作用敏感,HBO诱导的DNA损伤很大程度上由单链DNA断裂组成,这些损伤迅速修复。
通过全激酶组 CRISPR-Cas9 文库系统筛选骨肉瘤的潜在治疗靶点
摘要 目的:骨肉瘤是最常见的原发性恶性骨肿瘤,但由于缺乏有效的治疗靶点,骨肉瘤患者的生存期在过去 30 年中一直保持不变。方法:构建了包含 507 个激酶和 100 个非靶向对照的激酶组靶向 CRISPR-Cas9 文库,并筛选了骨肉瘤中潜在的激酶靶点。使用基于模型的全基因组 CRISPR/Cas9 敲除分析 (MAGeCK) Python 包分析 CRISPR 筛选测序数据。通过 lenti-CRISPR 介导的基因敲除将功能数据应用于 143B 细胞系。在 R2:基因组学分析和可视化平台中分析激酶在骨肉瘤患者生存中的临床意义。结果:我们确定了骨肉瘤中的 53 个潜在激酶靶点。在这些靶标中,我们分析了 3 种激酶,TRRAP、PKMYT1 和 TP53RK,以验证它们在骨肉瘤中的致癌功能。PKMYT1 和 TP53RK 在骨肉瘤中的表达高于正常骨组织,而 TRRAP 无明显差异。所有 3 种激酶的高表达与骨肉瘤患者的预后相对较差有关。结论:我们的研究结果不仅提供了骨肉瘤中潜在的治疗激酶靶标,而且还为使用 CRISPR-Cas9 文库进行功能性遗传筛选提供了范例,包括靶标设计、文库构建、筛选工作流程、数据分析和功能验证。该方法还可能有助于加速其他类型癌症的药物发现。关键词骨肉瘤;激酶;CRISPR-Cas9 文库;TRRAP;PKMYT1;TP53RK
药物预防骨肉瘤动物模型中手术加速的转移
摘要背景:骨肉瘤是一种高度转移性的原发性骨肿瘤,主要影响青少年和年轻人。骨肉瘤的主要治疗方法是切除原发肿瘤。然而,手术切除本身与促进肿瘤生长和转移有关,这种效应被称为手术加速转移。导致手术加速转移的潜在机制仍不清楚,但巨噬细胞功能的促肿瘤发生改变已被证实与此有关。方法:使用 K7M2-BALB/c 同系小鼠骨肉瘤模型研究手术对转移、巨噬细胞表型和总体生存的影响。利用吉非替尼(一种受体相互作用蛋白激酶 2 抑制剂,先前已证明可促进抗肿瘤巨噬细胞表型)研究了手术加速转移的药物预防。结果:手术切除原发肿瘤导致肺转移表面结节、总体转移负担和微转移灶数量增加。这种术后转移增强与肺内巨噬细胞表型转变为更有利于肿瘤的状态有关。吉非替尼治疗可防止巨噬细胞表型发生肿瘤支持性改变,从而减少转移。切除原发肿瘤并联合吉非替尼治疗可提高中位生存期和总生存期。结论:手术加速转移部分由巨噬细胞表型发生肿瘤支持性改变所介导。可在围手术期使用靶向药物疗法来防止巨噬细胞表型发生肿瘤支持性改变,以减轻手术加速转移并提高手术的治疗效果。
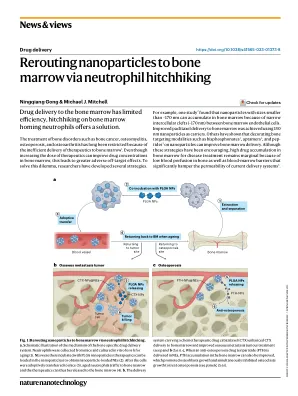
通过中性粒细胞搭便车将纳米粒子重新路由到骨髓
增殖。此外,PTH-NPs@NEs 改善了骨小梁矿物质密度、骨体积分数、骨小梁分离,并最终在体内治愈了骨质疏松症。鉴于骨癌和骨质疏松症治疗的挑战,这项工作展示了一种提高治疗效果的潜在方法。这项研究还对骨病治疗领域具有更广泛的意义,因为老化的中性粒细胞可能被用来将一系列治疗物质运送到骨髓微环境中,而不仅仅是化疗和抗骨质疏松药物。例如,携带放射增敏剂的 NE 在骨肿瘤中积累,可以潜在地增强抗肿瘤功效同时降低毒性,而携带包裹编码细胞因子或免疫检查点阻断的信使 RNA (mRNA) 的脂质纳米颗粒的 NE 可以诱导肿瘤特异性免疫反应用于癌症免疫治疗。此外,提供成像模式的 NE 可以帮助早期诊断各种骨病。本文描述的搭便车老化 NE 策略的一个主要优势是,它们可以通过骨髓向性运输改善骨微环境中货物的积累。观察这种基于 NE 的递送系统与用活性靶向配体(如单克隆抗体)修饰或功能化的纳米粒子相比如何将会很有趣。这种临床转化策略的优势包括:i) 中性粒细胞在血液中的浓度高,易于获得;ii) PLGA 已获得 FDA 批准用于多种药物递送应用。未来的研究应解决将药物递送到骨髓所需的大量老化 NE 是否会诱发不必要的毒性免疫反应,例如细胞因子释放综合征,正如许多过继性 T 细胞转移疗法中所报道的那样。
MYC 通过 microRNA 17/20a 调节 CSF1 表达,从而调节骨肉瘤中的肿瘤相关巨噬细胞
引言骨肉瘤 (OS) 是儿童和青少年中最常见且转移性最高的原发性骨肿瘤 (1)。尽管存在广泛的基因组畸变,但 OS 并没有特征性的 DNA 易位或可靶向的突变 (2)。因此,目前尚无针对 OS 的有效分子靶向疗法。然而,许多 OS 患者存在基因定义的体细胞 DNA 拷贝数改变,例如 8q24 染色体增加,约 20% 的 OS 患者有此表现 (3, 4)。8q24 基因座含有已知的致癌基因 c-MYC (MYC),它直接调节几种对不同细胞功能很重要的蛋白质编码和非编码基因,包括细胞周期调控、蛋白质生物合成、代谢、信号转导、转录和翻译 (5, 6)。已发现 MYC 在超过一半的人类癌症中失调 (7)。 8q24 区域扩增和 MYC 过度表达见于高级别癌前病变和侵袭性肿瘤,并且与不同人类肿瘤类型(包括 OS)的不良预后有关 (8–12)。除了对内在肿瘤细胞生物学的影响之外,MYC 的过度活化还会导致多种癌症的肿瘤免疫微环境 (TME) 发生改变 (13–15)。巨噬细胞是实体瘤(包括 OS)TME 中大量存在的细胞,通过释放独特的生长因子、细胞因子、趋化因子和酶 (16, 17),在宿主防御、组织修复、凋亡和组织稳态中发挥多功能作用。在成年人中,巨噬细胞在细胞因子巨噬细胞集落刺激因子 1 (M-CSF 或 CSF1) 的帮助下从外周血单核细胞分化。 CSF1 不仅调节单核细胞向巨噬细胞的分化,还通过与其受体 (CSF1R) 相互作用支持单核细胞/巨噬细胞的存活和增殖以及巨噬细胞的运动 (18)。肿瘤内致癌 MYC 在巨噬细胞调节中的作用已被证实。
通过 SYNC-T 疗法进行冷冻免疫疫苗接种 (CIV)
联系方式 1. Lin MJ、Svensson-Arvelund J、Lubitz GS、Marabelle A、Melero I、Brown BD、Brody JD。(2022 年)。癌症疫苗:下一个免疫治疗前沿。自然癌症 3:911-926。 2. Muller AJ、Thomas S、Prendergast GC。(2023 年)。癌症疫苗简要概述。癌症杂志。29:34-37。 3. Marabelle A、Kohrt H、Caux C、Levy R。(2014 年)肿瘤内免疫:癌症治疗的新范式。临床癌症研究。20:1747-1756。 4. Melero I、Castanon E、Alvarez M、Champiat S、Marabelle A。(2021 年)。癌症免疫疗法的肿瘤内给药和肿瘤组织靶向。 Nat Rev Clin Oncol. 18: 558 576。5. Sharma P、Siddiqui BA、Anandhan S、Yadav SS、Subudhi SK、Gao J、Goswami S、Allison JP。(2021 年)。免疫检查点疗法的下一个十年。Cancer Discov。11: 838-857。6. Velez A、DeMaio A、Sterman D。(2023 年)。非小细胞肺癌的冷冻消融和免疫:冷冻免疫疗法的新时代。Front Immuno。14: 1203539ff。7. Annen R、Kato S、Demura S、Miwa S、Yokka A、Shinmura K、Yokogawa N、Yonezawa N、Kobayashi M、Kurokawa Y、Gabata T、Tshuchiya H。(2022 年)。小鼠模型中局部冷冻消融治疗转移性骨肿瘤后的肿瘤特异性免疫增强作用。Int J Mol Sci 23: 9445ff。8. Smith C, Chang MY, Parker RH, Beury DW, DuHadaway JB, Flick HE, Boulden J, Sutanto-Ward E, Soler AP, Laury-Kleintop LD, Mandik-Nayak L, Metz R, Ostrand-Rosenberg S, Prendergast GC, Muller AJ。(2012)。IDO 是肺癌和转移发展的淋巴结致病驱动因素。Cancer Discov 2: 722-735。