XiaoMi-AI文件搜索系统
World File Search SystemMoxeparvovec
SGLT2抑制剂,SGLT2抑制剂组合的事先授权(PA)形式(二甲双胍,DPP-4delandistrogene moxeparvovec(levidys)
• Prescribed by a Neurology or Genetics provider • Patient has a definitive diagnosis of Duchene muscular dystrophy (DMD) based on documented clinical findings and prior genetic testing • Patient is a male • Patient is age 4 years old or older • Patient is ambulatory and able to complete the 10-meter walk test without assistance devices • Patient has anti-AAVrh74 total binding antibody titers <1:400 • Patient does not在DMD基因中的外显子8和/或外显子9中有任何缺失•患者没有接受外显子的疗法,或者必须在开始时至少停止至少1周,•患者未使用其他DMD基因疗法•患者以前没有使用过leveriDys。尚未研究重复给药,不建议•凯撒永久咨询医师小组对患者进行了审查,并建议使用药物
leverdys(delandistrogene moxeparvovec)
FDA批准的关键试验是第3阶段,随机,受控,双盲Endark试验(SRP-9001-301)。虽然尚未在同行评审期刊上发布,但提交给FDA的数据分析可用(Zhou 2024)。主要疗效终点,从基线到52周的NSAA得分的最小二乘平均变化在用Delandistrogene和安慰剂组治疗的组之间没有显着差异(2.57 vs 1.92,P = 0.244)。由于主要结果没有显示出显着差异,因此从基线到第52周的关键次要结果及时从地板上升到10分钟的步行/跑步测试。在两个指标的治疗组中都观察到了朝着优势的趋势,但是FDA分析师指出,应调整对这些终点的分析以进行多次比较,以减少I型错误的风险。
对Duchenne肌肉营养不良症患者的Delandistrogene moxeparvovec基因治疗的实际考虑
一个基因治疗中心,阿比盖尔·韦克斯纳研究所,全国儿童医院,俄亥俄州哥伦布市,俄亥俄州立大学,俄亥俄州立大学,哥伦布,俄亥俄州俄亥俄州,国王女儿的儿童医院Roche Ltd,巴塞尔,瑞士G Roche Products Ltd,Welwyn Garden City,英国H小儿神经病学研究所,天主教大学和Nemo Pediatico,Fondazione Policazione Policazione Policlinico gemelli Irccs,意大利罗马,意大利,杜巴维特街,伦敦伦敦街或大帝街,是伦敦伦敦街或大型街道J国家健康研究所,大奥蒙德街医院生物医学研究中心,伦敦,英国k k物理医学与康复部,加州大学戴维斯分校卫生局,加利福尼亚州萨克拉曼多一个基因治疗中心,阿比盖尔·韦克斯纳研究所,全国儿童医院,俄亥俄州哥伦布市,俄亥俄州立大学,俄亥俄州立大学,哥伦布,俄亥俄州俄亥俄州,国王女儿的儿童医院Roche Ltd,巴塞尔,瑞士G Roche Products Ltd,Welwyn Garden City,英国H小儿神经病学研究所,天主教大学和Nemo Pediatico,Fondazione Policazione Policazione Policlinico gemelli Irccs,意大利罗马,意大利,杜巴维特街,伦敦伦敦街或大帝街,是伦敦伦敦街或大型街道J国家健康研究所,大奥蒙德街医院生物医学研究中心,伦敦,英国k k物理医学与康复部,加州大学戴维斯分校卫生局,加利福尼亚州萨克拉曼多
转基因指导的免疫学研究对免疫介导的肌炎进行脱兰氏素蛋白肌炎,delandistrogene moxeparvovec▼基因疗法
•Delandistrogene Moxeparvovec是一种基于RAAVRH74载体的基因转移疗法,旨在通过传递编码Delandistrogene Moxeparvovece Moxeparvovec微型蛋白质的转基因的DMD中缺乏功能性营养不良蛋白来补偿DMD中的功能性障碍,这是一种工程蛋白,该蛋白质是一种固定功能型蛋白质的工具蛋白。1–3•截至2024年2月,在美国,阿联酋,卡塔尔和科威特批准了Delandistrogene moxeparvovec,用于治疗DMD基因中已确认突变的DMD的4至5岁的门诊儿科患者。4–7 *•在努力(SRP-9001-103; NCT04626674)中报道了两种严重的IMM的严重不良事件病例,这是一种开放标签,多核病期1B研究,评估DMD患者的Delandistrogene Moxeparvovec。8,9 - 病例1发生在同类群体2中的一名9岁患者中,并在dmd基因的3-43中删除了外显子,剂量后35天。病例2发生在同类术5中的7岁患者中,剂量后29天删除了DMD基因的外显子8-9。两名患者均经历了肌肉无力并接受了免疫抑制治疗,包括高剂量皮质类固醇和他克莫司。•在具有DMD基因序列的一部分的个体中,已删除了与转基因区域重叠的人,有微障碍蛋白被认为是异物的风险,进而引起免疫反应。由免疫系统检测到的一个必要条件是通过HLA-I或HLA-II呈现转基因的肽片段。†但是,并非所有涉及外显子1-17和/或59-71的患者都接受了Delandistrogene Moxeparvovec Gene Therapy Gene疗法的治疗。†但是,并非所有涉及外显子1-17和/或59-71的患者都接受了Delandistrogene Moxeparvovec Gene Therapy Gene疗法的治疗。•在这里,我们介绍了对这两种情况进行调查的结果。
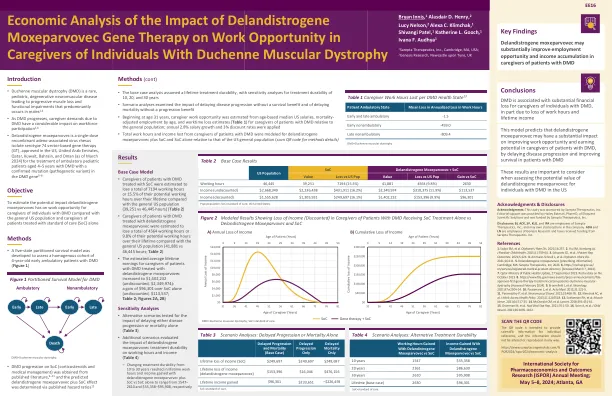
对DeLandistrogene Moxeparvovec基因疗法对工作机会的影响的经济分析
参考文献1。Szabo SM等。orphanet j Rare。2021; 16:237。2。yiu em,Kornberg AJ。J Paediatr儿童健康。2015; 51:759-64。 3。 Schwartz CE等。 j患者代表结果。 2021; 5:124。 4。 Ammann-Schnell L等。 orphanet j Rare。 2021; 16:211。 5。 delandistrogene moxeparvovec [处方信息]。 马萨诸塞州剑桥:Sarepta Therapeutics,Inc; 2023。 6。https://mohap.gov.ae/ en/services/nocended-medical-product-directory [2024年3月7日访问]。 7。 卡塔尔公共卫生部更新部,2023年9月27日。 文件中的Roche数据。 2023年10月。 8。https://www.fda.gov/news-events/press-announcements/fda-批准 - first-gene-therapy-therapy-warteatment-cneathment-pateriations-patients-duchenne-muscular-muscular- dismtrostrophrophy-访问[2024年2月访问]。 9。 Broomfield J等。 神经病学。 2021; 97:E2304-14。 10。 Passamano L等。 Acta Myol。 2012; 31:121-5。 11。 Paramsothy P等。 神经肌肉疾病。 2022; 32:468-76。 12。 Klimchak AC等。 J Mark Access健康政策。 2023; 11:2216518。 13。 Soelaeman RH等。 肌肉神经。 2021; 64:717-25。 14。 麦当劳CM等。 柳叶刀。 2018; 391:451-61。 15。 Osterman M等。 natl重要统计代表。 16。2015; 51:759-64。3。Schwartz CE等。j患者代表结果。2021; 5:124。4。Ammann-Schnell L等。orphanet j Rare。2021; 16:211。5。delandistrogene moxeparvovec [处方信息]。马萨诸塞州剑桥:Sarepta Therapeutics,Inc; 2023。 6。https://mohap.gov.ae/ en/services/nocended-medical-product-directory [2024年3月7日访问]。 7。 卡塔尔公共卫生部更新部,2023年9月27日。 文件中的Roche数据。 2023年10月。 8。https://www.fda.gov/news-events/press-announcements/fda-批准 - first-gene-therapy-therapy-warteatment-cneathment-pateriations-patients-duchenne-muscular-muscular- dismtrostrophrophy-访问[2024年2月访问]。 9。 Broomfield J等。 神经病学。 2021; 97:E2304-14。 10。 Passamano L等。 Acta Myol。 2012; 31:121-5。 11。 Paramsothy P等。 神经肌肉疾病。 2022; 32:468-76。 12。 Klimchak AC等。 J Mark Access健康政策。 2023; 11:2216518。 13。 Soelaeman RH等。 肌肉神经。 2021; 64:717-25。 14。 麦当劳CM等。 柳叶刀。 2018; 391:451-61。 15。 Osterman M等。 natl重要统计代表。 16。马萨诸塞州剑桥:Sarepta Therapeutics,Inc; 2023。6。https://mohap.gov.ae/ en/services/nocended-medical-product-directory [2024年3月7日访问]。7。卡塔尔公共卫生部更新部,2023年9月27日。文件中的Roche数据。2023年10月。8。https://www.fda.gov/news-events/press-announcements/fda-批准 - first-gene-therapy-therapy-warteatment-cneathment-pateriations-patients-duchenne-muscular-muscular- dismtrostrophrophy-访问[2024年2月访问]。9。Broomfield J等。 神经病学。 2021; 97:E2304-14。 10。 Passamano L等。 Acta Myol。 2012; 31:121-5。 11。 Paramsothy P等。 神经肌肉疾病。 2022; 32:468-76。 12。 Klimchak AC等。 J Mark Access健康政策。 2023; 11:2216518。 13。 Soelaeman RH等。 肌肉神经。 2021; 64:717-25。 14。 麦当劳CM等。 柳叶刀。 2018; 391:451-61。 15。 Osterman M等。 natl重要统计代表。 16。Broomfield J等。神经病学。2021; 97:E2304-14。 10。 Passamano L等。 Acta Myol。 2012; 31:121-5。 11。 Paramsothy P等。 神经肌肉疾病。 2022; 32:468-76。 12。 Klimchak AC等。 J Mark Access健康政策。 2023; 11:2216518。 13。 Soelaeman RH等。 肌肉神经。 2021; 64:717-25。 14。 麦当劳CM等。 柳叶刀。 2018; 391:451-61。 15。 Osterman M等。 natl重要统计代表。 16。2021; 97:E2304-14。10。Passamano L等。Acta Myol。2012; 31:121-5。 11。 Paramsothy P等。 神经肌肉疾病。 2022; 32:468-76。 12。 Klimchak AC等。 J Mark Access健康政策。 2023; 11:2216518。 13。 Soelaeman RH等。 肌肉神经。 2021; 64:717-25。 14。 麦当劳CM等。 柳叶刀。 2018; 391:451-61。 15。 Osterman M等。 natl重要统计代表。 16。2012; 31:121-5。11。Paramsothy P等。神经肌肉疾病。2022; 32:468-76。12。Klimchak AC等。J Mark Access健康政策。 2023; 11:2216518。 13。 Soelaeman RH等。 肌肉神经。 2021; 64:717-25。 14。 麦当劳CM等。 柳叶刀。 2018; 391:451-61。 15。 Osterman M等。 natl重要统计代表。 16。J Mark Access健康政策。2023; 11:2216518。13。Soelaeman RH等。肌肉神经。2021; 64:717-25。14。麦当劳CM等。柳叶刀。2018; 391:451-61。15。Osterman M等。 natl重要统计代表。 16。Osterman M等。natl重要统计代表。16。2021; 70:1-50。soim a和al。J儿童神经2021; 36:1095-1
A Gene Transfer Therapy Study to Evaluate the Safety of Delandistrogene Moxeparvovec (SRP-9001) in Participants With Duchenne Muscular Dystrophy (DMD)
这项研究是一项开放标签的单剂量基因转移疗法研究,评估了DMD男孩中Delandistrogene Moxeparvovec静脉内(IV)给药的安全性。这项研究最初设计为由2名同类群体组成12例。队列A将包括3个月至3岁的参与者,B包括4至7岁的参与者。没有参与者参加队列A。
2025年1月28日,Duchenne社区的亲爱的成员,...
2025年1月28日,Duchenne社区的亲爱的成员,根据您要求收到有关Duchenne病临床发展计划的最新信息,我们很高兴分享III期全球临床研究第二年的初步结果。Embark(NCT05096221)正在研究Moxeparvovec(levidys™)驾驶 - 在研究开始时年龄在四到七岁之间的Duchenne肌肉营养不良(DMD)的儿童中。以下是《踏入研究》第二年的主要结果:●在三个主要功能测试中观察到统计和临床上显着改善:北星级生成评估的门诊评估(NSAA)(NSAA),上升时间(TTR)和十分米步行(10 MWR),两年后,与Delanders进行治疗后两年外部相应的无关对照组。●在运动功能的度量中,与上一年相比,治疗后两年后,用Moxeparvovec Delandersitrogen治疗的患者与外部对照组的患者之间的差异有所增加。●尚未在安全方面出现新信号,确认了到目前为止的安全性配置文件连贯且可由Delandistrogene Moxeparvovec管理。现在会发生什么?参加Embark研究的患者将在接受Moxeparvovec delandersterogen治疗后至少进行五年,以监测安全性和临床结果。没有您的协作和合作伙伴关系,我们的研究工作将是不可能的。我们衷心感谢Duchenne社区的宝贵支持和参与临床研究,以帮助对Duchenne和Delandistrogene Moxeparvovec的了解。我们仍然可以满足任何需要并发送诚意的问候,Duchenne Roche Italia团队
2025年1月27日|罗氏(Roche)宣布了对Duchenne肌肉营养不良的Elevidys的新结果|新闻| Chugai Pharmaceutical Co。,Ltd。
Delandistrogene Moxeparvovec,一种正在开发的基因治疗产品(开发法:SRP-9001,
媒体和投资者发行
巴塞尔,2025年1月27日-Roche(六:RO,ROG; OTCQX:RHHBY)今天宣布了今天的前一年级的阳性顶线结果,这是一项全球,随机的,随机的,双盲阶段III的Everidys™(Delandistogene Moxeparvovec),Moxeparvovec),第一位归类基因治疗的人治疗了与Duchenne usc with and duchenne usc usc usc for duchnenne usc usc usc usc usc。在用leverdys治疗两年后,与预先指定的未经治疗的未经处理的外部对照组相比,在NSAA,TTR和10MWR的三个关键运动功能测量中,观察到具有统计学意义和临床意义的改进。*用Levidys治疗的个体与外部对照组中的个体之间的功能差异在给药后一到两年之间增加了。在一起,这些结果表现出一致,持续的利益,有利于leverdys。
2012年4月至2014年-DMD-UPDATE-GLOBAL-COMMUNITY- ...
○我们的团队继续对一年数据进行其他分析,并将在今年即将举行的会议上分享更新。○研究的第2部分(两年数据)将于2024年底完成,并将在未来的科学会议上介绍。●Roche正在与欧洲药品局(EMA)以及其他健康和报销当局进行讨论。计划今年向EMA提出申请。●目前,Delandistrogene Moxeparvovec在美国,巴林,科威特,阿曼,卡塔尔,卡塔尔和阿拉伯联合酋长国获得了4至5岁儿童的ABRAB ARABIRES,患有DMD,并在DMD基因中有确认的突变。