XiaoMi-AI文件搜索系统
World File Search Systemfacioscapulohumeral
facioscapulohumeral肌肉营养不良
当脊柱周围的肌肉削弱时,将色谱柱退出对准。未对准会导致脊柱侧弯,脊柱弯曲到侧面。当背部的肌肉较弱时,个体难以直立站立,脊柱在下背部向内弯曲,被称为Lordosis。脊柱侧弯和脊柱障碍可能在FSHD中是温和的。
faciosculohumeral肌肉营养不良临床试验的结果度量
摘要:Facioscapulohumeral肌肉营养不良(FSHD)是一种令人衰弱的肌肉营养不良,具有变化,严重性和进展的变化。虽然仍然无法治愈这种疾病,但自从双鸡蛋ox 4(Dux4)基因的表观遗传压缩的潜在机制导致骨骼肌毒性以来,朝着FSHD疗法的进展加速了。这促进了新的疗法的快速发展,以靶向DUX4表达和下游失调,从而导致肌肉变性。这些发现和临床前翻译研究为等待临床试验评估的疗法开辟了新的途径。正如领域预期的FSHD试验一样,对于早期和II期和III期试验,需求已增长,对肌肉功能的更可靠和量化的结果度量的增长。促进纵向临床评估的高级工具将大大提高试验的潜力,以确定成功改善疾病进展或允许肌肉功能恢复的治疗剂。在这里,我们讨论了当前和新兴的FSHD结果指标以及研究人员可能在将此类措施应用于FSHD临床试验设计和实施中所面临的挑战。
引用 Bouwman、LF、Maarel、Van Der、SM 和 Greef、JC de。 (2020 年)。针对 DUX4 治疗面肩肱型肌营养不良症的前景。
双同源框 4 (DUX4) 是一种转录因子,与人类胚胎四细胞阶段的合子基因组激活 (ZGA) 有关,在该阶段,它充当重复元件和分裂特异性基因的激活剂 [1,2]。人们认为 DUX4 在大多数躯体组织中受到表观遗传抑制,包括骨骼肌。面肩肱型肌营养不良症 (FSHD;MIM 158900) 是一种进行性神经肌肉疾病,其特征是面部、肩胛骨和肱骨肌肉不对称无力和萎缩 [3],D4Z4 大卫星重复序列的表观遗传抑制丧失。这导致 DUX4 基因座的转录活性,该基因座在每个 D4Z4 重复单元内编码 [4,5]。 DUX4 激活未受影响的骨骼肌中通常不表达的基因,包括在 ZGA 期间激活的基因和免疫系统基因 [6,7]。成肌细胞中 DUX4 过表达会诱导不同的毒性级联反应,包括氧化应激增加、无义介导的衰变抑制和肌肉生成抑制。这些变化最终
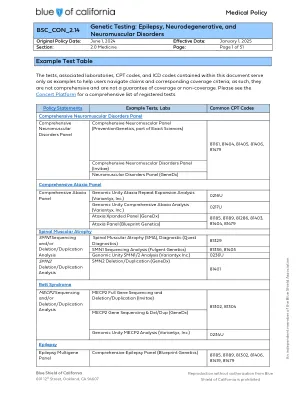
医疗政策BSC_CON_2.14基因测试:癫痫,...
1。具有一级或二级亲戚,对Duchenne或Becker肌肉营养不良的临床诊断。xxiii。dmd测序和/或缺失/重复分析(0218U,81161,81408)为所有其他适应症的研究都考虑了诊断Duchenne肌肉营养不良(DMD)或Becker肌肉营养不良(BMD)的诊断。facioscapulohumeral肌肉营养不良(FSHD)D4Z4单倍型分析和/或SMCHD1和DNMT3B测序和/或缺失/重复分析或Multigene Banel XXIV。D4Z4 haplotype analysis (81404), and/or SMCHD1 (81479) and DNMT3B (81479) sequencing and/or deletion/duplication analysis or multigene panel analysis (81404, 81479) to establish or confirm a diagnosis of facioscapulohumeral muscular dystrophy may be considered medically necessary when:
Roche神经病学更新虚拟IR事件2024年3月11日
1 bepranemab与UCB合作,目前由UCB进行研究; 2与Sarepta Therapeutics合作的Elevidys; NME =新分子实体; AI =其他指示; NMOSD =神经瘤性光谱谱系障碍; DMD = Duchenne肌肉营养不良; GMG =广泛的肌腱肌症; SMA =脊柱肌肉萎缩; fshd = facioscapulohumeral肌肉营养不良; mog-ad =髓磷脂少突胶质细胞糖蛋白抗体相关疾病; AIE =自身免疫性脑炎; MAGL =单酰基甘油脂肪酶
基因编辑针对DUX4聚腺苷酸化信号
摘要:Facioscapulohumeral营养不良(FSHD,OMIM:158900,158901)是成年人中最常见的Dys-Tropherphy,到目前为止,还没有治疗。已经表征了疾病的不同基因座,它们都导致Dux4蛋白的异常表达,这会损害肌肉的功能,最终导致细胞死亡。在这里,我们使用基因编辑来试图通过靶向其poly(a)序列永久关闭Dux4表达。我们在FSHD成肌细胞上使用了类似转录激活剂样效应子核酸酶(TALEN)和CRISPR-CAS9核酸酶。测序了150多个Topo克隆,仅观察到4%的indels。重要的是,在其中2个中,Dux4 poly(a)信号在基因组水平上被消除,但由于使用了非典型上游poly(a)信号序列,仍会产生DUX4 mRNA。这些实验表明,在基因组水平上靶向DUX4 PA可能不是FSHD治疗的适当基因编辑策略。
本演示文稿包含某些前瞻性内容...
*不包括 2023 年税务争议解决的影响,增长 12%,包括影响,增长 7%;基础业务=不包括 Ronapreve 的制药业务和不包括 COVID-19 相关产品的诊断业务;LOE=失去独占权,包括 Avastin、Herceptin、MabThera/Rituxan、Esbriet、Lucentis 和 Actemra 的全球损失;CER=恒定汇率(2023 年全年平均);PD=帕金森病;AD=阿尔茨海默病;CAR-T=嵌合抗原受体 T 细胞;DLL3=delta 样配体 3;ADC=抗体药物偶联物;SCLC=小细胞肺癌;ER=雌激素受体;HER2=人表皮生长因子;mBC=转移性乳腺癌;DLBCL=弥漫性大 B 细胞淋巴瘤;FL=滤泡性淋巴瘤;MDS=骨髓增生异常综合征; aHUS=非典型溶血性尿毒症综合征;HD=高剂量;RMS/PPMS=缓释/原发进行性多发性硬化症;COPD=慢性肺阻塞性疾病;SLE=系统性红斑狼疮;UME=葡萄膜炎性黄斑水肿;SMA=脊髓性肌萎缩;FSHD=面肩肱型肌营养不良症
2024 ISEK虚拟国会抽象程序
背景和目的:肌肉的机械行为决定了关节功能和人类运动。表征肌肉能力和体内主动力产生的长度范围对于监测肌肉变化至关重要。超声剪切波弹性图(SWE)通过测量组织内的剪切波传播速度来评估局部机械性能,以骨骼肌力学中的一种有希望的非侵入性方法出现[例如。1]。在这项研究中,我们探讨了SWE在检测与年龄有关的肌肉变化和疾病引起的肌肉变化方面的潜力,从而有助于对肌肉行为的全面理解。METHODS Biceps brachii muscle (BB) of healthy young (n=14; age: 28.1±5.1 years) [2] and older individuals (n=14;68.7±5.1 years) [3], and patients with myasthenia gravis (MG) (n=11; 47.6±15.7 years) [4] and facioscapulohumeral muscular dystrophy (FSHD) (n = 8; 42.1±14.0年)在五个肘角的休息和等轴测收缩过程中进行了研究。SWE,肌电图和关节力矩。导致被动条件(图1a),与年轻组相比,老年和MG组的BB弹性模量明显更高(例如老年组的最高可达52.6%)[3,4]。但是,FSHD组没有显着差异。在被动弹性模量与肘部角曲线的指数特征中观察到了实质性变化,这是由于老化和MG引起的。1b)。要利用这些信息作为肌肉力量的指数,必须为健康和患病状况开发肌肉模型。在活动状态下,与年轻人相比,在产生肘部矩时,年龄较大(25.1%),mg(26.5%)和FSHD(15.8%)组略有弱,但产生肘部矩的较弱。与年轻人组相比,在25%MVC时从较旧(20.3%)和FSHD(20.4%)组中测量的BB弹性模量显着降低,而MG组在75%MVC时降低了8.9%(图结论我们的发现表明,SWE能够检测BB肌肉力学的变化,有望在各种环境中监测这些变化,例如在MG的静止或高级活动中评估不同关节位置的肌肉,或在社区环境中评估老化和FSHD的衰老活动。虽然从SWE测量中得出的肌肉的被动和主动行为为理解肌肉适应的见解提供了见解,但它并没有阐明基本机制。此外,这些模型的验证将是向前迈出的至关重要的一步。将进一步探索这些方面,为该领域的未来研究奠定了基础。参考[1] Nordez A.& Hug F. J Appl Physiol 108(5),1389-1394,2010 [2] Zimmer M.等,J。Mech.Behav。生物疾病。垫子。137:105543,2023 [3] Ates F.等,《自然科学报告》,13(1):20062,2023 [4] Zimmer M.等,诊断,13(6),1108,20233ACKNOWLEDGMENTS BMBFTHENTHACKNOWLEDGMENTS THE BMBF-联邦教育部
纳米医学是治疗骨骼肌疾病的宝贵工具
肌营养不良症 (MD) 是一组罕见的遗传性疾病,会导致骨骼肌逐渐无力,并出现营养不良病理表型。它们分为九种主要类型:肌强直、杜兴氏、贝克尔、肢带、面肩肱型、先天性、眼咽型、远端型和埃默里-德雷富斯型 (Mercuri 等人,2019)。其中,成年人最常见的形式是肌强直性营养不良症 (DM),每 3000 人中就有 1 人受到影响,是由 DMPK(DM1:# 160900)或 CNBP(DM2:# 602668)基因座突变引起的(Mateos-Aierdi 等人,2015)。另一方面,儿童期最常见、最严重的遗传性营养不良症是杜氏肌营养不良症 (DMD,ONIM:#310200),每 5000 名新生男婴中就有 1 名患有此病 (Mendell 等人,2012 年),其原因是肌营养不良蛋白基因突变导致蛋白质完全缺失 (Ervasti & Sonnemann,2008 年;Hoffman 等人,1987 年)。总体而言,MD 涉及 40 多个基因的突变,这些基因导致不同的发病分子机制(详见 (Mercuri et al., 2019))。除了 MD 之外,在其他病理生理情况下也会观察到肌肉功能缺陷,例如大面积创伤、癌症或肌肉废用导致的萎缩(即身体固定后)(Sartori et al., 2021),或与年龄相关的肌肉质量损失、肌肉减少症(Muñoz-C anoves et al., 2020),这给不同的国家卫生系统带来了沉重的负担。因此,旨在改善生理和病理情况下的肌肉功能的策略和干预措施仍然是科学和医学界面临的关键挑战。在这种背景下,纳米医学提供了大量前所未有的工具,可以彻底改变我们看待骨骼肌疾病再生医学的方式。一方面,组织再生纳米医学利用纳米尺度材料作为药物输送系统 (DDS),利用细胞水平的内源性运输在纳米长度尺度上主动驱动这一事实 (Pozzi et al., 2014)。纳米粒子 (NPs) 的高表面体积比有利于生长因子 (Z. Wang, Wang, et al., 2017)、寡核苷酸 (Roberts et al., 2020)、细胞因子 (Raimondo & Mooney, 2018) 和其他生物活性剂的负载,以促进组织再生,而丰富的表面化学性质允许用靶向配体修饰 NPs,以确保更精确的输送。通过保护其有效载荷免于降解,NPs 可提高其药代动力学和生物利用度 (Fathi-Achachelouei et al., 2019)。就材料组成而言,有机纳米颗粒(即脂质体、聚合物、固体脂质纳米颗粒)具有悠久而成功的临床应用历史,可以保证良好的生物相容性和生物降解性(Colapicchioni,2020 年)。而无机纳米颗粒(即金属、氧化物、碳基、二氧化硅等)则表现出更高的化学稳定性,更容易合成和功能化,并且对内部(pH、温度、氧化还原电位)和外部(光、超声波和磁场)刺激具有良好的响应性(Mclaughlin 等人,2016 年)。此外,这些 NP 的独特光学特性(荧光、等离子体吸光度等)允许它们作为成像剂使用,因为它们允许在纳米图案支架或 DDS 内进行卓越的时空控制。然而,尽管具有这些吸引人的特性,无机 NP 在临床转化方面还不够成熟,而且它们的潜在毒性是一个值得关注的重要问题(Yang 等人,2019 年)。纳米医学彻底改变了骨骼肌再生的第二个领域是生物工程方法。骨骼肌再生研究的很大一部分集中在合成仿生支架以供细胞附着和生长以维持组织重建。纳米级材料的主要优势之一是可以优化这些支架的物理和生物特性,从而实现高度定制的平台。不同的纳米材料被用于优化支架的物理特性(即机械强度、电导性)并提供可控的生物活性剂释放。在这种情况下,纳米纤维支架通过改善系统架构提供拓扑支持以引导肌纤维分化和排列。另一方面,导电支架利用骨骼肌组织的内在兴奋性来调节肌肉细胞的存活、增殖和分化特性(Langridge 等人,2021 年)。本综述概述了纳米材料在肌肉疾病中的应用,重点介绍它们在组织工程方法和作为 DDS 的应用,并探索某些无机 NP 作为免疫调节剂的内在潜力(图 1)。本研究还将讨论该领域的未来前景以及限制这些纳米系统从实验室到临床的有效转化的困难。骨骼肌再生研究的很大一部分集中在合成仿生支架上,用于细胞附着和生长以维持组织重建。纳米级材料的主要优势之一是可以优化这些支架的物理和生物特性,从而实现高度定制的平台。不同的纳米材料被用来优化支架的物理特性(即机械强度、电导性)并提供受控的生物活性剂释放。在这种情况下,纳米纤维支架通过改善系统架构提供拓扑支持以引导肌纤维分化和排列。另一方面,导电支架利用骨骼肌组织的内在兴奋性来调节肌细胞的存活、增殖和分化特性(Langridge 等人,2021 年)。本综述概述了纳米材料在肌肉疾病中的应用,重点介绍了它们在组织工程方法和 DDS 中的应用,并探索了一些无机 NP 作为免疫调节剂的内在潜力(图 1)。本研究还将讨论该领域的未来前景以及限制这些纳米系统从实验室到临床的有效转化的困难。骨骼肌再生研究的很大一部分集中在合成仿生支架上,用于细胞附着和生长以维持组织重建。纳米级材料的主要优势之一是可以优化这些支架的物理和生物特性,从而实现高度定制的平台。不同的纳米材料被用来优化支架的物理特性(即机械强度、电导性)并提供受控的生物活性剂释放。在这种情况下,纳米纤维支架通过改善系统架构提供拓扑支持以引导肌纤维分化和排列。另一方面,导电支架利用骨骼肌组织的内在兴奋性来调节肌细胞的存活、增殖和分化特性(Langridge 等人,2021 年)。本综述概述了纳米材料在肌肉疾病中的应用,重点介绍了它们在组织工程方法和 DDS 中的应用,并探索了一些无机 NP 作为免疫调节剂的内在潜力(图 1)。本研究还将讨论该领域的未来前景以及限制这些纳米系统从实验室到临床的有效转化的困难。