XiaoMi-AI文件搜索系统
World File Search SystemShanghai Bio-heart Biological Technology Co., Ltd. 上海百 ...
Wuhan Gujian是一家在中国有限责任的公司,主要从事投资管理和投资咨询公司,最终由中国国家制药集团公司(National National Pharmaceical Group.Zhongantang是一家在中国有限责任的公司,主要从事健康管理咨询咨询公司,该咨询公司全资由Jiangbin Huang*(黄江彬)拥有。Yichuang Xinan是一个有限的合作伙伴关系,主要从事中国的技术开发和技术促进,由(i)Nanjing Gujian Jinquan Equity Investment Investment Co. Zhuorei”),Gujian(北京)资本管理公司,有限公司*(国健(北京)资本管理有限公司)(“ Gujian Beijing”)和Nanjing Kunrui Enterprise Consulting Consulting Co.,Ltd。上海Zhuorei是一家有限公司,成立于PRC主要从事企业管理咨询公司,由深圳Ruiersi管理咨询公司有限公司(Ltd.jiaxing Industrial Investment是一家在中国有限责任的国立公司,主要从事股票投资和投资管理。gujian Beijing是一家有限公司,该公司主要从事投资管理和资产管理,由Guojian Financial Leasing Co.,Ltd。*(国健融资租赁有限公司)控制,该公司由中国国家药品集团公司(National National Pharmaceutical Group.nanjing kunrui是一家有限公司,该公司主要从事企业管理咨询公司,并由Yufen He(贺玉芬)和Chunhua Zhang(分别为99%和1%)所有; (ii)公司(作为有限合伙人); (iii)Jing Bao*(保京)(作为其有限合作伙伴)。Zhejiang Xingnan是一家在中国建立的国立公司,其责任有限,主要从事股票投资。
上海复旦微电子集团股份有限公司
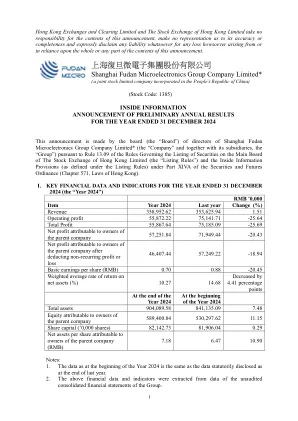
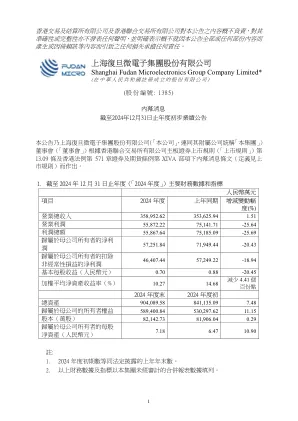
增加研发(“ R&D”)费用。 在2024年,该小组继续通过连续技术迭代和新产品研发对研发进行大量投资,以丰富产品序列,以实现更多的应用领域,并基于多元化的供应方技术来增强产品开发。 在2024年,研发费用约为1,030,651,500元人民币,与去年相应的期间相比,增加了约20,053,900元。 增加了损失损失。 在2024年,该集团的信用障碍损失增加了约32,037,300元人民币,而去年主要是由于高度可靠客户的应收账款余额增加。 对资产的减值损失的规定增加了约35,248,600令吉,而去年的主要原因是某些库存的可实现净值下降。增加研发(“ R&D”)费用。在2024年,该小组继续通过连续技术迭代和新产品研发对研发进行大量投资,以丰富产品序列,以实现更多的应用领域,并基于多元化的供应方技术来增强产品开发。在2024年,研发费用约为1,030,651,500元人民币,与去年相应的期间相比,增加了约20,053,900元。增加了损失损失。在2024年,该集团的信用障碍损失增加了约32,037,300元人民币,而去年主要是由于高度可靠客户的应收账款余额增加。对资产的减值损失的规定增加了约35,248,600令吉,而去年的主要原因是某些库存的可实现净值下降。
上海复旦微电子集团股份有限公司
于2024年度,本集团持续保持了加大的研发投入,持续进行技术迭代和新品研发,不断丰富的产品类型满足更多应用领域,并加大了基于信心供方工艺的产品研发。于2024年度研发,研发费用约为人民币103,065.15万元,较上年同期增加约人民币2,005.39万元。减值损失计划提增加。于2024年度每年,本集团主要因高可靠客户的应收账款余额增加,计提信用减值损失较上年增加约为人民币3,203.73万元。 因存货中部分产品可变现净值下降,计提资产减值损失较上年增加约人民币3,524.86万元。
安集微电子科技(上海)股份有限公司关于变更公司总经理的 ...
MICROELECTRONICS PTE. LTD. 董事。 2020 年 12 月 25 日起至今担任公司运营
证券交易所公告
可能超过 2100 万 1 葛兰素史克公司 (LSE/NYSE: GSK) 今天宣布了 AREXVY(佐剂型呼吸道合胞病毒疫苗)在 18-49 岁因某些潜在疾病而患呼吸道合胞病毒 (RSV) 引起的下呼吸道疾病 (LRTD) 高风险成人和免疫功能低下的成人中的初步数据。这些数据表明,该疫苗有助于保护更广泛的处于危险中的成人群体免受 RSV 潜在的严重后果的影响。仅在美国,具有至少一种可能使他们面临 RSV 疾病风险的 18-49 岁成人数量就可能超过 2100 万。1该疫苗目前已获准用于主动免疫,以预防 50 多个国家 60 岁及以上成人由 RSV 引起的 RSV-LRTD,以及包括美国和欧洲在内的多个国家 50-59 岁处于高风险中的成人*。目前还没有推荐 60 岁以下患呼吸道合胞病毒疾病风险较高的成年人接种呼吸道合胞病毒疫苗,尽管这一人群的疾病负担很重。葛兰素史克首席科学官 Tony Wood 表示:“这些有希望的数据为支持葛兰素史克呼吸道合胞病毒疫苗提供了更多证据,有助于将保护范围扩大到更多患呼吸道合胞病毒疾病风险的成年人。它们还为第二剂疫苗对某些人群的潜在影响提供了宝贵的见解。我们致力于与卫生当局和监管机构合作,帮助患呼吸道合胞病毒疾病风险较高的成年人从疫苗接种中受益。”在 IIIb 期试验 (NCT06389487 2 ) 中,单剂疫苗在因某些潜在疾病而患 RSV-LRTD 风险较高的 18-49 岁成年人 (n=395) 中引发了强烈的免疫反应。免疫反应不劣于 60 岁及以上成年人 (n=417) 的免疫反应,达到了试验的共同主要终点。在 IIb 期试验 (NCT05921903 3 ) 中,单剂疫苗在因肾脏或肺移植而免疫功能低下的 18 岁及以上成年人 (n=131) 中表现出强大的免疫反应,第二剂 (n=130) 引起的反应与接受过一剂疫苗的 50 岁及以上健康成年人 (n=125) 相似。这些免疫反应对于所有组 (接受 1 或 2 剂疫苗的人) 的 RSV-A 和 RSV-B 亚型都是一致的。这些数据将于今天在 CDC 免疫实践咨询委员会会议上公布。在这两项研究中,安全性和反应原性数据与支持疫苗初步批准的 III 期计划的结果一致。最常见的局部不良事件是疼痛,最常见的全身不良事件是疲劳、肌痛、关节痛和头痛,其中大多数是短暂的和轻微的。
证券交易所公告
关于 FIRST 试验 FIRST-ENGOT-OV44 试验是一项国际性、双盲、随机 III 期 ENGOT 试验,由葛兰素史克公司赞助,由法国妇科肿瘤合作组织 GINECO 牵头。FIRST 正在研究将多司他利单抗添加到标准治疗 (SOC) 铂类化疗和尼拉帕尼维持治疗中(联合或不联合贝伐单抗),作为 III 期或 IV 期非粘液上皮性卵巢癌的一线治疗。最初,参与者以 1:1:2 的比例随机分成三组:第 1 组:SOC 化疗,然后进行安慰剂维持治疗;第 2 组:SOC 化疗,然后进行尼拉帕尼维持治疗;第 3 组:SOC 化疗和多司他利单抗,然后进行尼拉帕尼和多司他利单抗维持治疗。研究者可自行决定在所有组中添加贝伐单抗。由于 PARP 抑制剂获批用于一线治疗,第 1 组 (n=193) 已关闭,参与者随后按 1:2 随机分配至第 2 组 (n= 385) 和第 3 组 (n= 753)。主要终点是第 2 组和第 3 组的研究人员评估的 PFS。次要终点包括 OS、PFS2、第一次和第二次后续治疗的时间。
证券交易所公告
肿瘤的生长和进展并提高耐受性,弥补当前治疗方法的差距 • 此次收购扩充了 GSK 在胃肠道 (GI) 癌症领域的产品组合 • GSK 将支付高达 11.5 亿美元 GSK plc (LSE/NYSE: GSK) 和 IDRx, Inc. (IDRx) 今天宣布,他们已达成协议,GSK 将收购 IDRx,这是一家位于波士顿的临床阶段生物制药公司,致力于开发用于治疗 GIST 的精准疗法。根据协议,GSK 将预付 10 亿美元,并有可能在成功获得监管批准后额外支付 1.5 亿美元的里程碑付款。此次收购包括先导分子 IDRX-42,这是一种高度选择性的 KIT TKI,正在开发作为治疗 GIST 的一线和二线疗法。 GIST 通常出现在胃肠道中,80% 的病例是由 KIT 基因突变引起的,这种突变会导致肿瘤细胞生长、增殖和存活(原发性或激活突变)。1 90% 的一线治疗患者会出现新的 KIT 突变(继发性或耐药性突变),这通常会导致复发,治疗选择有限。2 目前,尚无获批的 TKI 可以抑制 KIT 中临床相关的所有原发性和继发性突变。IDRX-42 已证明对所有关键的原发性和继发性 KIT 突变均有效,旨在改善 GIST 患者的预后。这种广泛的突变覆盖范围,加上可以提高耐受性的高选择性,为同类最佳产品提供了潜力。GSK 首席商务官 Luke Miels 表示:“IDRX-42 补充了我们不断增长的胃肠道癌症产品组合。此次收购符合我们收购资产的方法,这些资产针对的是经过验证的目标,并且尽管已有获批产品,但仍存在明显未满足的医疗需求。” GSK 首席科学官 Tony Wood 表示:“IDRX-42 的早期数据及其独特的能力让我们感到兴奋,该能力可以针对 GIST 中存在的所有临床相关 KIT 突变,而这是当前标准治疗的一个重大差距。我们期待在 2025 年加速其开发,以重新定义治疗方法。”StrateGIST 1 的最新临床数据是正在进行的 IDRX-42 对晚期 GIST 患者的 I/Ib 期试验,在结缔组织肿瘤学会 (CTOS) 2024 年年会上以口头报告的形式进行了介绍。这些数据显示,IDRX-42 对晚期 GIST 患者具有良好的抗肿瘤活性,且安全性可控。在二线或更大 GIST 患者中以及所有 KIT 突变亚组中,根据改良 RECIST v1.1 标准,总疗效可评估人群的客观缓解率 (ORR) 为 29% (n=87),包括 1 例完全缓解 (CR) 和 24 例部分缓解 (PR)。在接受过一线治疗的患者中,ORR 为 53% (n=15),其中包括 1 例 CR 和 7 例 PR。3 在所有患者中,在数据截断时,两个 PR 正在等待确认,随后均得到确认。StrateGIST 1 的新耐久性数据也令人满意。IDRX-42 通常耐受性良好,在推荐的 Ib 期剂量下,治疗相关不良事件 (TRAE) 主要为低级别。4
上海.pdf
九层校园旨在表达大学的国际化精神,融合了多种建筑和文化传统。它的庭院融合了西方的“克里斯特郡”启发的四边形和中国学者花园。Some facilities include a 5,000 square-meter library, 4,000-square-meter athletics space including a fitness center and two gymnasiums, a colloquium space, a state of the art recital hall, a 600-person auditorium, thble NYU Shanghai Institute of Contemporary Arts with 600 square meters of exhibition space, a multi-level open space canteen that can seat several hundred diners, and classroom spaces that accommodate一系列学生(从数十个到数百人)都具有先进的数字设备,以满足在线,离线和混合模式教学的需求。
证券交易所公告
终点已达到葛兰素史克公司 (LSE/NYSE: GSK) 今天宣布,美国食品药品监督管理局 (FDA) 已接受审查其五合一脑膜炎球菌 ABCWY (MenABCWY) 候选疫苗的生物制品许可申请 (BLA)。美国 FDA 对此申请作出监管决定的处方药使用者付费法案 (PDUFA) 行动日期为 2025 年 2 月 14 日。GSK 的五合一 MenABCWY 候选疫苗结合了其两种已得到充分认可且具有公认疗效和安全性的脑膜炎球菌疫苗的抗原成分,即 Bexsero(B 组脑膜炎球菌疫苗)和 Menveo(脑膜炎球菌 [A、C、Y 和 W-135 组] 寡糖白喉 CRM 197 结合疫苗)。 MenABCWY 组合疫苗将针对导致全球大多数侵袭性脑膜炎球菌病 (IMD) 病例的五种脑膜炎奈瑟菌 (Men A、B、C、W 和 Y)。1 将这些疫苗提供的保护结合到更少的注射中旨在减少注射次数,简化免疫接种。这有助于提高系列完成率和疫苗接种覆盖率,并有助于减轻 IMD 的总体负担,未接种疫苗的青少年特别容易感染和爆发疫情。2,3,4 IMD 是一种不可预测但严重的疾病,可能导致危及生命的并发症。5 尽管接受治疗,感染 IMD 的人中仍有六分之一的人会死亡,有时死亡时间短至 24 小时。6,7 五分之一的幸存者可能会遭受长期后果,例如脑损伤、截肢、听力丧失和神经系统问题。8 虽然任何人都可能感染 IMD,但十几岁和成年早期的人属于感染风险较高的群体。 9,10 在美国,尽管自 2015 年以来就已建议接种所有五种血清群的脑膜炎球菌疫苗,但由于接种时间表复杂,IMD 的年度免疫接种率总体上仍然很低。11 MenB 是美国青少年和年轻人中最常见的 IMD 致病菌群,占 2017 年至 2021 年美国该年龄组中 IMD 病例的一半以上。12 为了预防 MenB,该疫苗受美国疾病控制与预防中心共同临床决策建议的约束,只有不到 12% 的美国青少年接种了两剂必需的疫苗。 10 在 III 期临床试验 (NCT04502693) 中,MenABCWY 候选疫苗实现了所有主要终点,包括与一剂 GSK 的 A、C、Y 和 W 群脑膜炎球菌疫苗相比,免疫学不劣于一剂,以及与两剂 GSK 的 B 群脑膜炎球菌疫苗相比,对 110 种不同的 MenB 侵袭性菌株(占美国流通的 MenB 菌株的 95%)的免疫反应不劣于两剂。该疫苗耐受性良好,安全性与两种疫苗一致。13
证券交易所公告
2018 5 葛兰素史克公司 (LSE/NYSE: GSK) 今天宣布,欧洲药品管理局 (EMA) 已接受审查 Shingrix(葛兰素史克的重组带状疱疹疫苗,简称 RZV)预充式注射器的监管申请,该申请用于预防带状疱疹。新型预充式注射器无需在注射前重新配制单独的小瓶,为医生、药剂师和其他负责接种疫苗的医疗保健专业人员提供了一种便捷的选择。该疫苗的当前形式由冻干(粉末)抗原和液体佐剂组成,医疗保健专业人员在注射前将它们混合在一起。新形式与重新配制的疫苗成分相同,提交申请基于证明两者可比性的数据。5 此次欧洲监管审查是在美国 FDA 于 2025 年 1 月 8 日接受新型预充式注射器申请之后进行的,这延续了葛兰素史克致力于提供解决方案以提高成人免疫接种率的承诺。 GSK 还在研究将此演示文稿提交给其他市场。自 2018 年起,GSK 的带状疱疹疫苗已在欧盟获批用于预防 50 岁及以上成人的带状疱疹 (HZ) 和带状疱疹后神经痛 (PHN);自 2020 年起,用于预防 18 岁及以上患有 HZ 风险较高的成人。6 关于带状疱疹 带状疱疹通常表现为皮疹,胸部、腹部或面部出现疼痛的水疱。7 皮疹出现后,多达 30% 的人会出现 PHN,8 这是一种长期的神经痛,可持续数周或数月,有时可持续数年。1 带状疱疹还会造成巨大的医疗保健和人力成本,57% 的带状疱疹患者报告平均缺勤 9.1 天。9 带状疱疹是由水痘-带状疱疹病毒 (VZV) 重新激活引起的,该病毒也是导致水痘的病毒。 1 到 50 岁时,大多数成年人都会感染 VZV 10,有些成年人可能会随着年龄的增长而重新激活。 7 随着年龄的增长,免疫系统对感染的反应强度会减弱,这会增加患带状疱疹的风险。 7 关于 Shingrix(重组带状疱疹疫苗,或 RZV) Shingrix(GSK 的重组带状疱疹疫苗,或 RZV)是一种非活体重组亚单位疫苗,适用于预防 50 岁及以上的成年人患上带状疱疹。它结合了抗原糖蛋白 E 与佐剂系统 AS01B,可能有助于克服与年龄相关的免疫反应的自然下降,这种下降加剧了保护 50 岁及以上的成年人免受带状疱疹的挑战。11,12 RZV 不适用于预防原发性水痘感染(水痘)。在一些国家,RZV 也被批准用于 18 岁或以上患带状疱疹风险较高的成年人。 RZV 的使用应符合官方建议和当地产品标签。请参阅产品信息 (PI) 了解重要的剂量、用法、在欧洲,可通过以下链接获取有关药物安全性的信息:https://www.ema.europa.eu/en/medicines/human/EPAR/shingrix 关于葛兰素史克 葛兰素史克是一家全球生物制药公司,其宗旨是联合科学、技术和人才,共同战胜疾病。更多信息请访问 gsk.com。