XiaoMi-AI文件搜索系统
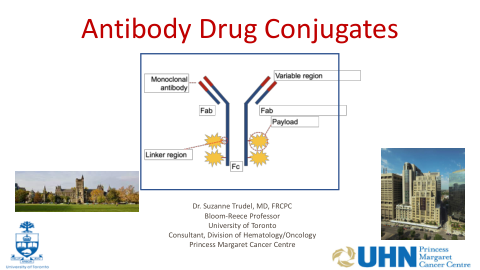
World File Search System抗体药物偶联物
*中位随访时间为 11.5 个月(范围,0.6-24.2)。† 中位随访时间为 10.8 个月(范围,0.0-26.4)。‡ 成熟度为 37.5%。AE,不良事件;CR,完全缓解;ITT,意向治疗;mDOR,中位缓解持续时间;mOS,中位总生存期;mPFS,中位无进展生存期;MR,最小缓解;NE,不可评估;NR,未达到;ORR,总体缓解率;PD,进展性疾病;Pd,泊马度胺/地塞米松;PR,部分缓解;RRMM,复发/难治性多发性骨髓瘤;sCR,严格完全缓解;SD,病情稳定;VGPR,非常好的部分缓解。Weisel K. 发表于:美国临床肿瘤学会年会;2023 年 6 月 2 日至 6 日;伊利诺伊州芝加哥。演示文稿 8007。
多发性骨髓瘤的抗癌药物耐药性
正文 克服 MM 细胞固有和获得性耐药性,特别是在免疫抑制肿瘤微环境 (TME) 背景下,仍然是有效治疗高风险或复发/难治性 (R/R) MM 的重大挑战 [1-15] 。药物转运蛋白 P-糖蛋白 (P-gp/ABCB1) 和多药耐药相关蛋白 1 (MRP1/ABCC1) 的扩增表达与 MM 细胞对已知这些蛋白的底物药物(如美法仑、地塞米松和蒽环类药物)的耐药性有关 [表 1] [16-18] 。一些研究表明,另一种药物转运蛋白肺耐药蛋白 (LRP) 的丰富表达水平也可能赋予 MM 对化疗药物和蛋白酶体抑制剂 (PI) 的耐药性 [16-18] 。是否能够鉴定出这些药物转运蛋白的有效且安全的抑制剂,并在临床上加以利用,以克服耐药性,仍有待观察。
选择独特的路径-XPOVIO®(Selinexor)
XPOVIO®(SELINEXOR)是一种处方药:•与硼替佐米和地塞米松联合治疗多发性骨髓瘤的成年患者,这些患者至少接受过一种先前的疗法。尚不清楚Xpovio在不到18岁的儿童中是否安全有效。您的医疗保健提供者将在您开始服用Xpovio之前,通常在治疗的前3个月,然后在治疗期间根据需要进行血液检查。Xpovio可能会引起严重的副作用,包括:•低血小板计数。低血小板计数对于Xpovio很常见,可能导致出血,这可能很严重,有时会导致死亡。您的医疗保健提供者可以为低血小板计数开出血小板输血或其他治疗方法。在Xpovio治疗期间,您是否有任何出血或易于瘀伤,请立即告诉您的医疗保健提供者。请在整个过程中查看重要的安全信息,完整的处方信息和药物指南。
处方珍珠:DPP-4抑制剂(Gliptins)的指南
药物相互作用在DPP-4抑制剂和任何其他药物之间尚无明显相互作用。gliptins不会显着修改其他药物的药代动力学特征和暴露,反之亦然。因此,当吉普汀与其他药理剂结合使用时,通常不建议调整剂量。这是Saxagliptin的显着例外。saxagliptin被CYP3A4/5酶代谢为活性代谢产物。9暴露于萨克萨利普汀及其主要代谢产物时,当萨克萨拉汀与特异性较强抑制剂共同管理时,会显着改变(例如酮康唑,diltiazem)或诱导剂(例如利福平,地塞米松),cyp3a4/5。血糖控制。与其他降低血糖的药物一起使用DPP-4抑制剂具有加性作用。因此,降低了独立于葡萄糖水平的药物的剂量(例如可以指示避免低血糖。9
achard-thiers综合征在绝经后妇女
实验室测试被排序,并指示正常的睾丸激素水平,但DHEA和DHEA-S水平升高。此外,高HBA1C水平为8.9%,促使胰岛素治疗启动以及二甲甲酸酯和半卢皮德。甲状腺功能测试得出了正常的结果,排除了甲状腺相关疾病,尿液分析对尿感染呈阴性。最初的鉴别诊断认为垂体腺瘤和肾上腺疾病既促使大脑的MRI,脑部不包括垂体腺瘤并确认肾上腺病理学。此外,对1 mg过夜地塞米松的抑制不足以及ACTH测试的增加证实了肾上腺受累。进一步评估促性腺激素水平,特别是LH和FSH,落在正常范围内,进一步支持肾上腺诊断。患者报告带有测试结果的报告如表1所示。
CRISPR-CAS9基因组和长期非编码RNA作为前列腺癌治疗的新型诊断指数,该指数通过脂质体涂层化合物
crispr/cas9是一种最近发现的基因组编辑技术,它改变了科学家在研究基因功能方面的视力。cas9通过引导(g)RNA控制,该引导符合裂解以修饰相应基因的DNA。前列腺癌(PC)建模的发展不仅是针对识别前列腺细胞癌的信号传导途径的新型资源的,而且还为检查治疗的治疗剂来抵消这种类型的癌症的治疗方法创造了广泛的储藏。已经开发了几乎模仿人类前列腺癌的各种培养的针对前列腺癌的体细胞大鼠模型。纳米药物可以通过特定的传说增加生物利用度和结合来被动地靶向癌细胞,从而有助于系统性降低和提高疗效。本文重点介绍了脂质体负载的纳米米医学作为前列腺罐的潜在治疗方法,并阐明了伴有前列腺癌的CRISPR/CAS9变异。PC是通过乙基雌二醇在西大鼠模型中实验诱导的4周和SC。剂量为3,2'-二甲基-4-氨基苯基雌二醇(DAE)(50mg/kg),然后通过靶向脂质体涂层化合物进行处理,然后通过脂质体涂层化合物(例如脂质体去氨甲米松(DXM)),脂质体doxoru- doxoru- bicIn(dox)和四周(dox)(dox)(dox)(dox)turmical iperic(turmic of turmical(turmic of turmeric of)对其非靶向类似物地塞米松,阿霉素和姜黄的比较研究。3,2'-二甲基-4-氨基苯基雌二醇在5个月内引起西部大鼠的前列腺癌。 据报道,包括Malat1在内的前列腺细胞癌中对几个长的非编码RNA进行了管制。3,2'-二甲基-4-氨基苯基雌二醇在5个月内引起西部大鼠的前列腺癌。据报道,包括Malat1在内的前列腺细胞癌中对几个长的非编码RNA进行了管制。与这些脂质体化合物同时补充对前列腺癌的影响;通过前列腺特异性抗原(PSA),一氧化氮(NOX)和CRISPR/CAS9基因编辑研究了肿瘤标记。 另一方面,还研究了apoptotic生物标志物局灶性激酶(AKT-1),磷脂酰氨基烷醇激酶(PI3K)和糖原合酶激酶3(GSK-3)的基因表达,并还研究了这些结果,并通过HIS-HIS-拓扑核对学检查了这些结果。 脂质体负载的地塞米松;阿霉素和姜黄可以通过调节CRISPR/CAS9基因编辑和长期非编码基因MALAT1来视为前列腺癌的有希望的治疗剂。与这些脂质体化合物同时补充对前列腺癌的影响;通过前列腺特异性抗原(PSA),一氧化氮(NOX)和CRISPR/CAS9基因编辑研究了肿瘤标记。另一方面,还研究了apoptotic生物标志物局灶性激酶(AKT-1),磷脂酰氨基烷醇激酶(PI3K)和糖原合酶激酶3(GSK-3)的基因表达,并还研究了这些结果,并通过HIS-HIS-拓扑核对学检查了这些结果。脂质体负载的地塞米松;阿霉素和姜黄可以通过调节CRISPR/CAS9基因编辑和长期非编码基因MALAT1来视为前列腺癌的有希望的治疗剂。
最佳药物疗法,用于不合格多发性骨髓瘤
配方管理专家委员会(FMEC)得出的结论是,系统审查和网络荟萃分析(NMA)中的证据支持在多发性骨髓瘤患者中使用一线daratumumab,这些患者无资格进行移植。fmec指出,在新诊断的含daratumumab的患者中,诸如达氏蛋白酶蛋白的治疗方案,daratumumab和bortezomib Plus bortezomib Plus Melphalan Plus Prednisone和Daratumumab Plus Denalidomide Plus Lenalidomide Plus Dexamethasone在与Base Alidem andaliDomemane dexnaliDomeN中的统计上显着差异。在复发或难治性多发性骨髓瘤中,达拉特珠单抗加,列纳替米德和地塞米松在与Lenalidomide和Dexametherone相比,无进展生存期的统计学显着差异。然而,根据使用公开价格的经济分析的结果,需要在一线环境中,在一线环境中,将这种治疗的价格降低才能在常规的意愿付费阈值中被认为是具有成本效益的。
手足综合征病例介绍及文献综述
讨论:对该综合征进行了叙述性回顾;最常见的临床表现涉及手和脚,因此得名“手足综合征”,但它有多种术语。最初报道发生在接受高剂量阿糖胞苷治疗急性白血病的患者中,也有完整的描述,一种理论指出它可能是由化疗在手掌和脚掌中大量的汗腺中积累引起的。导致汗腺管上皮化生和局灶性坏死;化疗时发病率高,在 2% 到 60% 之间。症状平均持续 6.4 天,68% 的初始发作涉及手和脚,例如手部疼痛和不适,限制日常生活活动,例如行走、握住物体和执行简单任务,并且为了确定其严重程度,使用不同的仪器进行分期,主要与对患者生活质量的影响有关; 27% 需要镇痛治疗和局部治疗。种族和性别与此无关,只有高龄和不使用地塞米松的高剂量化疗与此有关。
nirmatrelvir/ritonavir(paxlovid),remdesivir(veklury)
1。严重免疫抑制剂:抗CD-20代理::利妥昔单抗,ocrelizumab,atumumab,ofatumumab,obinutuzumab,ibritumomomab,tositumomab; B细胞耗尽剂:Epratuzumab,Medi-551,Belimumab,BR3-FC,AMG-623,Atacicept,AtaCicept,Antibr3,Alemtuzamab 2。Moderately immunosuppressive agents: Biologics : abatacept, adalimumab, anakinra, benralizumab, brodalumab, canakinumab, certolizumab, dupilumab, etanercept, golimumab, guselkumab, infliximab, interferon products (alpha, beta, and pegylated forms), ixekizumab, mepolizumab,natalizumab,omalizumab,resilizumab,risankizumab,sarilumab,secukinumab,tildrakizumab,tocilizumab,ustekinumab,ustekinumab或vedolizumab; Oral immune-suppressing drugs : azathioprine, baricitinib, cyclophosphamide, cyclosporine, leflunomide, dimethyl fumerate, everolimus, fingolimod, mycophenolate, siponimod, sirolimus, tacrolimus, tofacitinib, upadacitinib, methotrexate, or teriflunomide;持续的口服类固醇:地塞米松,氢化可的松,甲基泼尼松龙或泼尼松;免疫抑制输注/注射:克拉德林,环磷酰胺,glatiramer,甲氨蝶呤
新闻稿 Sarclisa 在欧盟获批,成为首个与标准治疗 VRd 联合用于治疗不适合移植的淋巴细胞白血病的抗 CD38 疗法
• 该批准基于 IMROZ 3 期研究的积极结果,该结果证明 Sarclisa 与标准治疗方法相结合可显着改善 TI NDMM 的 PFS,而单独使用标准治疗方法则不然 • 代表欧盟的第三种适应症,其中两种用于治疗 R/R MM 成年患者,一种用于治疗 NDMM 巴黎,2025 年 1 月 22 日。在欧洲药品管理局 (EMA) 人用药品委员会 (CHMP) 采取积极意见后,欧盟已批准 Sarclisa 与标准治疗方法硼替佐米、来那度胺和地塞米松 (VRd) 相结合,用于治疗不适合自体干细胞移植 (ASCT) 的新诊断多发性骨髓瘤 (NDMM) 成年患者,基于来自 IMROZ 3 期研究的数据。随着扩大营销授权,Sarclisa 成为欧盟首个针对该患者群体与 VRd 联合使用的抗 CD38 疗法。