XiaoMi-AI文件搜索系统
World File Search System玉米基因组中膜联蛋白基因家族的进化,变异和表达模式
膜联蛋白(ANNS)是一个在植物生长,发育和压力反应中起关键作用的进化保守,依赖钙依赖性的磷脂结合蛋白的家族。利用26个高质量玉米基因组的泛基因组,我们鉴定了12个ANN基因,其中包括9个核心基因(以所有26条线为单位)和3个近核基因(以24-25条为单位)。这突出了基于单个参考基因组研究ZMANN基因的局限性。评估26个品种中ANN基因的KA/KS值表明Zmann10在某些品种中处于正选择状态,而其余基因的Ka/ks值小于1,表明纯化选择。系统发育分析将ZMANN蛋白分为六组,其中VI仅包含ZMANN12。某些品种的结构变化改变了保守的结构域,产生了许多非典型基因。转录组分析表明,不同的ANN成员在各种组织以及不同的非生物和生物应力处理下具有不同的表达模式。在冷应力下,来自各种玉米组织的转录组数据的加权基因共表达网络分析鉴定出参与共表达模块的四个ANN基因(Zmann2,Zmann6,Zmann7,Zmann9)。总体而言,这项研究利用高质量的玉米pangenomes对Zmann基因进行生物信息学分析,为ZMANN基因的进一步研究提供了基础。
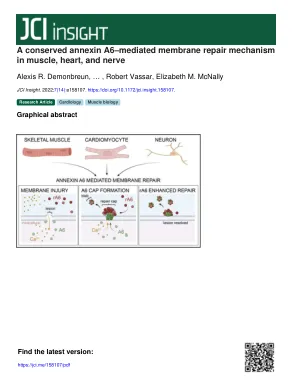
肌肉,心脏和神经中保守的膜联蛋白A6介导的膜修复机制
引言质膜经常暴露于机械破坏,导致膜病变,该膜病变的形状和大小可能因细胞类型和功能而变化。在功能稳定或修复质膜的基因中的突变与多种不同的疾病有关,包括肌肉营养不良,心肌病和神经病(1,2)。随着膜破裂,细胞外Ca 2+的涌入可以启动质膜修复。在小膜病变的情况下,已经提出了几种质膜修复模型(3-5)。在一个模型中,细胞内囊泡以Ca 2+依赖性方式募集到损伤部位,它们彼此融合并融合到膜病变(6-8)。第二个模型暗示了受伤的膜的收缩,随后芽出来,并将受伤的膜脱落到细胞外空间中(9-12)。其他人除了膜向损伤部位的横向扩散外,还描述了受伤的膜区域的内吞作用(13-16)。这些模型的各个方面最终可能有助于膜修复和重新密封,部分地取决于细胞类型以及膜破坏的大小和深度。介导膜修复的机械参与其他细胞运输过程,脚手架受体和信号传导复合物以及调节肌动蛋白动力学的调节,这些动力学并非专用于膜修复。膜联蛋白以Ca 2+依赖性的方式与带负电荷的磷脂结合,除细胞迁移和粘附外,其在膜修复中的作用已被认可(17-22)。在肌肉膜修复的情况下,受伤部位形成了修复盖。附属蛋白A1,A2和
双配位金属有机骨架作为新型多功能纳米载体用于肝癌靶向药物治疗
转染后 48 小时收获细胞。胰蛋白酶消化后,进行 FITC-膜联蛋白 V 和碘化丙啶 (PI) 染色。使用流式细胞术用膜联蛋白 V-FITC 和 PI 的死细胞凋亡试剂盒 (Invitrogen,目录号:V13242) 分离凋亡细胞 (早期)。单克隆抗体使用与绿色荧光 FITC 染料结合的重组膜联蛋白 V 检测凋亡细胞中磷脂酰丝氨酸的外化,使用 PI 检测死细胞,其中 PI 将坏死细胞染成红色荧光。用两种探针处理后,凋亡细胞显示绿色荧光,死细胞显示红色和绿色荧光,活细胞几乎不显示荧光。Navios
膜联蛋白 A6 通过与三阴性乳腺癌细胞中的 SNAP23 相互作用调节促炎细胞因子和外泌体的分泌
摘要 促炎细胞因子通过经典途径从分泌囊泡分泌或通过非经典途径从细胞外囊泡 (EV) 分泌,它们共同在三阴性乳腺癌 (TNBC) 进展中发挥关键作用。膜联蛋白 A6 (AnxA6) 是一种 Ca 2+ 依赖性膜结合蛋白,在 TNBC 中与细胞生长和侵袭性有关。AnxA6 与 EV 相关,但它是否影响促炎细胞因子和/或 EV 的分泌仍有待完全阐明。为了评估 AnxA6 是否影响细胞因子和细胞外囊泡的分泌,我们使用细胞因子阵列分析了对照 AnxA6 表达和 AnxA6 下调的 MDA-MB-468 TNBC 细胞澄清培养上清液中的分泌因子。这表明,AnxA6 下调后,单核细胞趋化蛋白 1 (MCP-1/CCL2)、白细胞介素 8 (IL- 8)、dickkopf1 (DKK1)、血细胞反应蛋白-1 (TSP-1) 和骨桥蛋白 (OPN) 的分泌减少。我们还表明,在 AnxA6 下调的细胞中,小 EV 的分泌显著减少,而 AnxA6 的上调促进了治疗的分泌,也与 Rab7、胆固醇和 MCP-1 水平相关的 EV 增加有关。此外,在 AnxA6 表达细胞中,EV 中的胆固醇含量明显高于 AnxA6 下调的细胞,并且在长期拉帕替尼诱导 AnxA6 上调后。从机制上讲,我们证明 MCP-1 和/或 EVs 的分泌依赖于 AnxA6,这需要 AnxA6 易位到细胞膜并与 SNAP23 相互作用。AnxA6 中和抗体大大降低了 AnxA6 低 TNBC 细胞的存活率,但对表达相对高水平蛋白质的 TNBC 细胞的存活率影响甚微。总之,这些数据表明 AnxA6 促进 EVs 和促炎细胞因子的分泌,这可能对 TNBC 进展至关重要。关键词:膜联蛋白 A6、促炎细胞因子、外泌体、细胞外囊泡、SNAP23、分泌、三阴性乳腺癌简介
巨噬细胞中膜联蛋白A1的丧失通过激活CGA/STING途径来限制胰腺癌中的递增和重塑胰腺癌的免疫微环境
抽象的客观胰腺癌是一种无法治愈的恶性疾病,预后极不良和复杂的肿瘤微环境。我们试图表征膜联蛋白A1(ANXA1)在胰腺癌中的作用,包括促进肿瘤性肿瘤病和抗肿瘤免疫反应的能力。通过免疫组织化学和免疫荧光检查了151例胰腺癌病例中151例胰腺癌病例中,Anxa1和裂解的caspase-3(C-CASP3)的肿瘤表达和肿瘤浸润的CD68 +巨噬细胞的数量。使用髓样特异性的Anxa1-敲除小鼠研究了Anxa1在胰腺癌中的作用。通过单细胞RNA测序和流式细胞术评估了巨噬细胞中Anxa1缺乏引起的肿瘤浸润免疫细胞群体的变化。结果胰腺癌患者样品中的Anxa1表达与CD68 +巨噬细胞的数量相关。Anxa1 +肿瘤 - 浸润巨噬细胞的百分比与C-CASP3表达负相关,并且与较差的生存率显着相关。在小鼠中,髓样特异性的ANXA1缺乏症抑制了肿瘤的生长,并伴随着凋亡细胞在胰腺肿瘤组织中的积累,这是由于抑制巨噬细胞肿瘤的抑制作用,这依赖于CGAS刺激途径诱导的I型I型干扰素信号传导。Anxa1缺乏症可以通过增加效应T细胞和促炎性巨噬细胞的数量来显着重塑肿瘤轴承小鼠中肿瘤内淋巴细胞和巨噬细胞室。结论这项研究发现了巨噬细胞anxa1在胰腺癌中的新作用。此外,对焦虑症与吉西他滨和抗编程的细胞死亡蛋白-1抗体的结合疗法导致胰腺肿瘤生长的协同抑制作用。ANXA1-通过肿瘤相关巨噬细胞对肿瘤的介导的调节可通过刺激信号传导促进抗肿瘤免疫反应,这表明胰腺癌的潜在治疗策略。
焊接添加剂制造:文献审查22β-羟基丁酮通过抑制MMP -9活性和MAPK信号传导
Ethnopharmacological relevance: 22 β -hydroxytingenone (22-HTG) is a quinonemethide triterpene isolated from Salacia impressifolia (Miers) A. C. Smith (family Celastraceae), which has been used in traditional medicine to treat a variety of diseases, including dengue, renal infections, rheumatism and cancer.但是,尚未阐明22-HTG和黑色素瘤细胞中潜在的分子机制的抗癌作用。研究的目的:本研究研究了SK-MEL-28人黑色素瘤细胞中22-HTG的凋亡诱导和抗转移性势力。材料和方法:首先,评估了22-HTG在培养的癌细胞中的体外细胞毒性活性。然后,使用黑色素瘤细胞(SK-MEL-28)中的锥虫蓝色测定法确定细胞活力,其随后是细胞周期,膜联蛋白V-FITC/碘化碘化物测定(膜联蛋白/PI),以及用于评估线粒体膜潜力的测定,使用反应性牛(Recatige oxygen cytomry)评估线粒体膜潜力。使用Acridine橙/溴化乙锭(AO/BE)染色的荧光微副本。RT-QPCR以评估BRAF,NRA和KRAS基因的表达。在重建的人类皮肤的三维(3D)模型中评估了22-HTG的抗侵入性潜力。结果:22-HTG降低了SK-MEL-28细胞的生存力,并导致形态学变化,因为细胞收缩,染色质凝结和核碎裂。此外,22-HTG引起了凋亡,通过用AO/BE和Annexin/pi染色来证明,这证明了这一点。凋亡可能是由于线粒体不稳定性引起的,而无需ROS产生。通过22-HTG处理降低了BRAF,NRA和KRAS的表达,它们是黑色素瘤发育中重要的生物标志物。在重建的皮肤模型中,22-HTG能够降低真皮中黑色素瘤细胞的侵袭能力。
质子泵抑制剂(PPIS)的Jurkat T淋巴细胞凋亡诱导
凋亡(通常称为程序性细胞死亡)不断发生在人类中。随着癌细胞的酸度增加,诱发了凋亡。在健康细胞中,质子泵蛋白允许H +离子渗透到细胞膜,从而调节pH值。然而,质子泵抑制剂(PPI),例如奥美拉唑,防止质子运动,导致pH调节。在先前的研究中,奥美拉唑诱导了Jurkat T淋巴细胞的细胞死亡;但是,尚无证实细胞是通过细胞凋亡或通过坏死而死亡的,而细胞爆发。通过使用膜联蛋白-V染色,可以测量奥美拉唑,右氯唑唑和埃索美吡唑对凋亡诱导的影响。细胞死亡。右兰索拉唑和埃索美拉唑在18小时时均达到100%的凋亡,表明它们具有较早的凋亡激活点。为了测量细胞活力的程度,通过用小钙蛋白 - 乙酰氧基甲基(AM)染料染色细胞来测量胞质酯酶活性。Jurkat细胞暴露于Omeprazole,Dexlansoprazole和Esomeprazole六个小时,并监测30小时以测量生存能力。阿霉素是一种已知的化学治疗性,在测试凋亡诱导和生存力时也被用作阳性对照。使用荧光显微镜成像时,由于膜联蛋白V-FITC的结合而导致凋亡荧光的任何细胞以及由于PI的结合而导致的坏死细胞荧光。用钙软蛋白AM(如果细胞荧光,它们)被认为是可行的,而非荧光细胞被认为是坏死的。在30小时的标记下,右倾角唑的生存力最小(40.0±3.5%的细胞可行),其次是阿霉素(62.9±1.8%),埃索美普唑(66.2±1.6%)和欧洲普拉唑(69.29±2.01%)(69.29±2.01%),在比较(71%)中(71%)(71%)。右兰索拉唑的生存能力低,表明需要使用相同的PPI和暴露方法进行毒性研究,以确定最佳药物浓度。奥美拉唑和埃索美瑞唑的最佳浓度为1 µm,右兰索拉唑啉为0.5 µm。未来的研究包括使用膜联蛋白V-FITC和碘化丙啶(PI)染料在确定浓度下测试细胞死亡方法。
新型磷酸酶NUDT5是三阴性乳腺癌生长的关键调节剂
将细胞周期同步48小时,使用1 M甲氯酸酯释放细胞24小时。根据制造商的说明,我们使用了溴脱氧尿苷(BRDU)检测试剂盒(Roche细胞增殖ELISA,BRDU(化学发光)套件)。DRAQ7™(ABCAM,AB109202)添加到细胞中。HOECHST(Hoechst(Thermo Fisher Scientific™,Hoechst 33342溶液,Waltham MA)根据制造商的建议来对抗染色核。使用ImageXpress®PICO显微镜(Molecular Devices,San Jose,CA)对染色的细胞进行成像,并使用CellReporterXpress图像采集和分析软件进行分析。根据制造商的建议,使用了膜联蛋白V-PI(Invitrogen,Annexin v-Fitc结合物,Waltham MA)凋亡测定法,并通过流量
口服肿瘤血管系统的开发-...
我们之前报道过,与膜联蛋白 A1 (ANXA1) N 端结合的 IF7 肽在静脉注射后可作为针对肿瘤血管的药物递送载体。为了增强 IF7 在体内的稳定性,我们使用代表 ANXA1 N 端的合成 D 肽作为靶标,进行了镜像肽噬菌体展示。然后,我们确定了肽序列,将其合成为 D 氨基酸,并将得到的肽命名为 dTIT7,我们显示它与 ANXA1 N 端结合。注射了近红外荧光 IRDye 偶联的 dTIT7 的小鼠脑肿瘤模型的全身成像显示大脑和肾脏中出现荧光信号。此外,口服 dTIT7/凝胶-达那霉素 (GA) 偶联物可抑制脑肿瘤的生长。我们进行了一项概念验证实验,表明 ANXA1 结合 D 肽可以开发为口服的肿瘤血管靶向治疗方法。