XiaoMi-AI文件搜索系统
World File Search SystemLP3718 - 非隔离电源
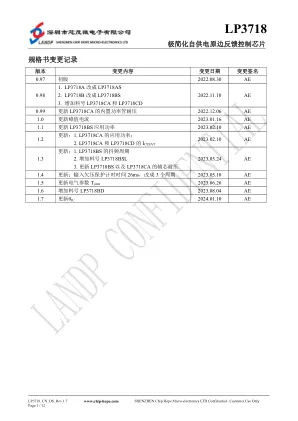
印章说明: X :第一个字母代表年份, A : 2014 年, B : 2015 年, C : 2016 年, D : 2017 年 ...... 按顺序依此类推 X :第二个数字或字母代表周数,第 1 周:数字 1,2345678 依此类推到第 9 周:数字 9 。第 10 周开始用 大写字母 A B C......Z, 依此类推“ Z ”代表第 35 周。第 36 周开始用小写字母 abcd......z 依此类推到本年份 的最后一周。 XX :第三个和第四个代表内部序号
LP3710 - 非隔离电源
恒压状态下,芯片内部恒流环 CC_COMP 电压大 于 3.5V ,当输出负载电流 I O1 突然增大到 I O2 (超 过恒流输出电流 I OCP ), CC_COMP 会从高电压下 降到 3.5V 以下。当 CC_COMP 下降到 3.5V 时, 芯片会短暂关闭恒流控制,继续以恒压方式工作, 进入 P EAKLOAD 模式,系统升频, I O2 越大频率越大, 并且允许的最大频率增加至 F PKMAX ;与此同时会 启动内部的 P EAKLOAD 模式计时功能,保证此模式 的最大工作时间不会超过预设的 T HOLD 。计时时间 达到 T HOLD 后,芯片会强行退出 P EAKLOAD 模式, 并且会激活一个屏蔽时间 T BLANK 的计时,以确保 允许下一次进入 P EAKLOAD 模式至少超过此 T BLANK 时间;与此同时,会激活内部恒流模块的工作, 在这种情况下,由于负载还是 I O2 ,所以系统的输 出电压会持续下降,直至触发 H ICCUP 保护、系统 重启。
Kansai医科大学概述2024Kansai医科大学概述2024
成立于1928年,Kansai医科大学(KMU)的历史悠久,并庆祝今年成立96周年。kmu基于其Jijinshinkyo的创始精神,即“仁慈,同情和同情心”,培养了具有丰富人性意识的优秀医生。随着与医疗保健相关的条件的迅速变化,社会越来越期望大学对大学的期望更多。kmu正在回应社会作为一所综合医科大学的期望,包括三个学院:医学学院和广阔的吉拉卡塔校园的护理学院,该校园充满了绿色植物,位于Yodogawa和Amanogawa Rivers,Amanogawa Rivers,以及Makino Campus of Hirtplace of Hirteplace kmu的Hablialitation。最近在KMU举行的活动是2022年2月的KMU塔的完成。塔楼是全球参与中心,KMU的全球化基地,国际学生的住房和医院酒店。这座塔楼是广场市中心最高的建筑结构之一,是KMU的象征和城市地标的象征。此外,2022年4月开设了近红外照片免疫疗法研究所的KMU。这是日本唯一的摄影疗法研究所,它具有第五次主要的癌症疗法。我们希望这将进一步推进KMU的教育,研究和医疗服务。KMU医院是一家指定的高级治疗医院,保持创新并且能力很高。其他后设施的设施是KMU医疗中心,第一家KMU分支机构,设有医院花园,
A Case Study 非互联农村地区可再
摘要:超过 100,000 人分散在农村地区或外岛,仍在使用非联网发电系统,例如火力发电。由于依赖化石燃料导致电力成本过高,生态平衡被破坏。然而,就低碳经济而言,岛屿/农村地区的能源转型 (ET) 更快,因为那里的可再生能源潜力非常大。本文介绍了一种可连接农村地区/外岛的可再生微型混合电网系统。本研究论文基于先前的文献,对偏远岛屿/农村地区进行了比较分析。本文确定的业务系统的应用旨在鼓励引入可再生能源 (RE) 并促进岛屿/农村地区的 HRE-MG 利用。本文特别讨论了实现 ET 的先进成功的目标。ET 开发可以涉及政府和私营部门,以支持实现这些目标。此外,必须为某些地区寻找资金来源作为援助的替代方案,并且需要外国投资者。必须建立国际和政府层面的合作,以便有效的政策能够支持地方层面的能力建设。HRE-MG 在岛屿/农村地区的应用适合企业投资可再生能源服务,因为这些地区的可再生能源技术成本和税收优惠价值较低。
lai_cv.pdf - lucy lai 赖璐西
邀请会谈新加坡国立大学认知科学,心理学和AI研讨会系列系列2025年2月2025年赖斯大学,欧米茄PSI荣誉学会,2024年10月5日,《神经科学数学国际公约和AI国际公约》 2024年5月,5月5日1223年6月2023年6月2023年6月2022年2022年11月222日在增强地图上学习的RLDM研讨会,2022年6月2022年6月,斯坦福大学,心理学系,2022年5月,弗里塞姆弗里斯姆,哈佛大学,认知,大脑,大脑和行为SEMINAR,脑和行为SEMINAR,2022年2022年2月202日,麦克格尔大学,玛丽·麦克格尔大学。 Shenhav实验室2021年10月
西地那非
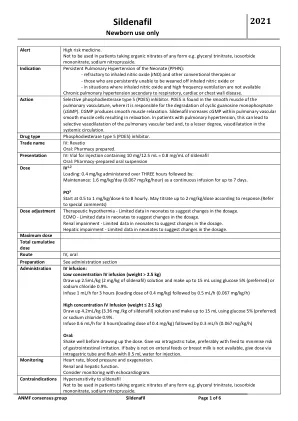
- 对吸入一氧化氮(INO)和其他常规疗法或 - 那些持续无法断奶的氧化氧化氮或 - 在吸入一氧化氮和高频性频率的情况下,持续性肺部肺动脉症是慢性肺部或胸膜疾病。作用选择性磷酸二酯酶5型(PDE5)抑制剂。pDE5在肺脉管系统的平滑肌中发现,在该肺部的平滑肌中,它负责循环鸟嘌呤一磷酸(CGMP)的降解。CGMP会产生平滑肌松弛。西地那非增加肺血管平滑肌细胞中的CGMP,导致松弛。在患有肺动脉高压的患者中,这可能导致肺血管床的选择性血管舒张,并且在较小程度上会导致全身循环中的血管舒张。药物型磷酸二酯酶5型(PDE5)抑制剂。商业名称IV:Revatio
录用稿件,非最终出版稿
引用本文: 种峻楷, 胡广超, 高建明, 霍向涛, 郭敏, 程芳琴, 张梅.面向未来“双碳”形势下低阶煤高值化利用研究进展与思考[J].北科 大:工程科学学报 , 优先发表.doi: 10.13374/j.issn2095-9389.2024.10.02.001 CHONG Junkai, HU Guangchao, GAO Jianming, HUO Xiangtao, GUO Min, CHENG Fangqin, ZHANG Mei.Research progress and new thoughts for high-value utilization of low-rank coal according to the future “dual-carbon” policy[J].Chinese Journal of Engineering , In press.doi: 10.13374/j.issn2095-9389.2024.10.02.001
Cirrus Aircraft Limited 西锐飞机有限公司
香港交易及结算所有限公司、香港联合交易所有限公司及香港中央结算有限公司对本文件的内容概不负责,亦不对其准确性或完整性作出任何陈述,并明确表示,对于因本文件全部或部分内容而产生或因依赖该等内容而引致的任何损失,概不负责。本文件的副本连同“附录五 — 交付公司注册处处长并可供展示的文件”所列文件,已根据《公司(清盘及杂项条文)条例》(香港法例第 32 章)第 342C 条的规定,由香港公司注册处处长登记。证券及期货事务监察委员会及香港公司注册处处长对本文件或上述任何其他文件的内容概不负责。
Cirrus Aircraft Limited 西锐飞机有限公司
香港交易及结算所有限公司、香港联合交易所有限公司及香港中央结算有限公司对本文件的内容概不负责,对其准确性或完整性不作任何陈述,并明确表示,对于因本文件全部或部分内容而产生或因依赖该等内容而引致的任何损失,概不负责。本文件的副本连同“附录五 — 交付公司注册处处长并可供展示的文件”所载文件,已根据《公司(清盘及杂项条文)条例》(香港法例第 32 章)第 342C 条的规定,由香港公司注册处处长登记。证券及期货事务监察委员会及香港公司注册处处长对本文件或上述任何其他文件的内容概不负责。