XiaoMi-AI文件搜索系统
World File Search System恒运智能股份有限公司 王提浩 博士 首席技术官...
贸易/设备名称:EFAI RTSuite CT HN 分割系统 法规编号:21 CFR 892.2050 法规名称:医学图像管理和处理系统 监管类别:II 类 产品代码:QKB 日期:2022 年 1 月 28 日 收到日期:2022 年 1 月 31 日 亲爱的王 Ti-Hao: 我们已审查了您根据第 510(k) 条提交的上市前通知,该通知意在销售上述设备,并已确定该设备与在 1976 年 5 月 28 日(医疗器械修正案颁布日期)之前在州际贸易中合法销售的同类设备基本等同(就附件中规定的用途而言),或与根据《联邦食品、药品和化妆品法案》(法案)的规定重新分类的设备基本等同,这些设备不需要获得上市前批准申请(PMA)的批准。因此,您可以销售该设备,但须遵守该法案的一般控制规定。虽然本函将您的产品称为设备,但请注意,一些已获准的产品可能是组合产品。位于 https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpmn/pmn.cfm 的 510(k) 上市前通知数据库可识别组合产品提交。该法案的一般控制条款包括年度注册、设备列表、良好生产规范、标签以及禁止贴错标签和掺假的要求。请注意:CDRH 不会评估与合同责任担保相关的信息。但我们提醒您,设备标签必须真实且不得误导。如果您的设备被归类(见上文)为 II 类(特殊控制)或 III 类(PMA),则可能会受到其他控制。影响您设备的现有主要法规可在《联邦法规》第 21 篇第 800 至 898 部分中找到。此外,FDA 可能会在《联邦公报》上发布有关您设备的进一步公告。请注意,FDA 发布实质等效性判定并不意味着 FDA 已判定您的设备符合该法案的其他要求或其他联邦机构管理的任何联邦法规和规章。您必须遵守该法案的所有要求,包括但不限于:注册和列名(21 CFR 第 807 部分);标签(21 CFR 第
新西兰排放交易体系 (ETS) NZU 盈余建议
不得因报告内容或向第三方提供报告而对安永提出任何索赔或要求或任何诉讼或程序。安永将永远免于承担任何此类索赔、要求、诉讼或程序。在编制本报告时,安永已考虑并依赖客户和参与流程的其他利益相关者以及其他被认为可靠和准确的来源向我们提供的信息。安永并未被告知任何提供给它的信息或从公共来源获得的信息是虚假的,或任何重大信息被隐瞒。安永并不暗示,也不应被解释为安永已对提供给我们的任何信息执行了审计、验证或尽职调查程序。安永未独立验证任何此类信息,也不承担独立验证此类信息的任何责任或义务,也不对信息的准确性或完整性作出任何陈述。安永或其任何成员或员工均不承担任何责任,对于因向安永提供不正确信息而导致本报告中的错误而给任何人造成的任何损失或损害,亦不承担任何责任。
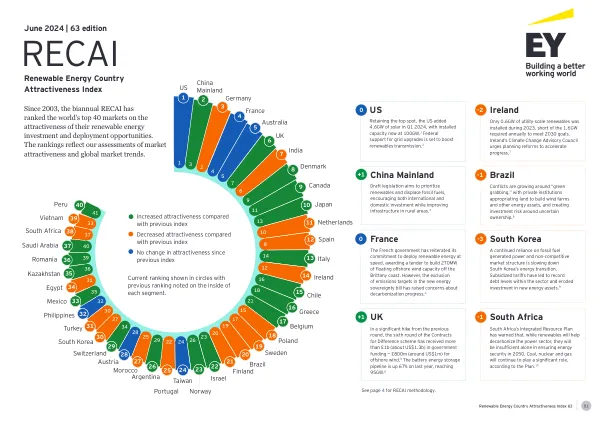
RECAI 63 前40名排名
安永是安永全球有限公司的全球组织,也可能指其一个或多个成员机构,每个成员机构都是独立的法人实体。安永全球有限公司是一家英国担保有限公司,不向客户提供服务。有关安永如何收集和使用个人数据以及个人根据数据保护法所享有的权利的描述,请访问 ey.com/privacy。安永成员机构不在当地法律禁止的地区执业。如需了解有关我们组织的更多信息,请访问 ey.com。
章 二 郎) 68 号 STtJDIESON THE BIOSYNTHESISOF ...
微生物对生物素的生物合成研究 (主审员) 论文研究委员会 绪方光一教授 镰田久明教授 岩井和夫教授
粉末DED方法的建模技术3D金属添加剂制造机LAMDA
Ishii Hirohisa * 1 Kuramoto Hirohisa * 2 Koh Ishii Hirohisa Kuramoto Tauchi Takushi * 2 Yamamoto Yusuke * 3 Hiroyuki Tauchi Yusuke Yamamoto Wakana Tomohiro * 3 Yoshimura Jin * 3 Tomohiro Wakana Hitoshi Yoshimura
经济和社会影响报告
安永会计师事务所 (“EY”) 受微软加拿大公司 (“微软”) 委托开展一项社会和经济影响研究。在编制本文件 (“报告”) 时,安永依赖来自第三方来源、微软、协会、学术和研究机构以及公共部门的未经审计的数据和信息 (统称为“支持信息”)。如果我们在本报告发布后获得更多支持信息,安永保留修改本报告中提及的任何分析、观察或评论的权利。安永假定支持信息准确、完整且适用于本报告的目的。安永未审计或独立核实支持信息的准确性或完整性。因此,安永不对支持信息发表任何意见或其他形式的保证,也不对任何错误或遗漏或因任何人将本报告用于编制目的以外的任何目的而造成的任何损失或损害承担任何责任。