XiaoMi-AI文件搜索系统
World File Search System表观转录组学作为骨骼肌基因表达调控的新层面:已知功能和未来前景
摘要:表观转录组学是指通过影响 RNA 功能的 RNA 修饰和编辑来对基因表达进行转录后调控。已描述了多种类型的 mRNA 修饰,其中包括 N6-甲基腺苷 (m6A)、N1-甲基腺苷 (m1A)、7-甲基鸟苷 (m7G)、假尿苷 (Ψ) 和 5-甲基胞苷 (m5C)。它们改变 mRNA 结构,从而改变稳定性、定位和翻译效率。表观转录组的扰动与人类疾病有关,因此为潜在的治疗方法提供了机会。在这篇综述中,我们旨在概述表观转录组标记在骨骼肌系统中的功能作用,特别是在胚胎肌生成、肌细胞分化和肌肉稳态过程中。此外,我们探索了高通量表观转录组测序数据来识别肌肉特异性基因中的 RNA 化学修饰,并讨论了可能的功能作用和潜在的治疗应用。
Petunjuk PenggunaanQiaamp®DSPDNA FFPE组织...
包含:盐酸鸟苷和马来酸。警告!如果被吞下或吸入可能是危险的。引起皮肤刺激。引起严重的眼睛刺激。可以对皮肤引起过敏反应。如果仍然发生眼睛刺激:获取医疗建议/护理。如果暴露在眼睛上:用水小心地冲洗几分钟。删除隐形眼镜(如果有的话)。继续冲洗。脱下污染的衣服并洗涤,然后再次穿着。如果暴露在皮肤上:用肥皂和流水洗涤。如果出现皮肤刺激:获得医疗建议/治疗。戴防护手套/防护服/眼保护器/面部保护器。
基于化学邻域的 N4-羟基胞苷靶向景观
。CC-BY-NC-ND 4.0 国际许可,根据 提供(未经同行评审认证)是作者/资助者,他已授予 bioRxiv 永久展示预印本的许可。它是此预印本的版权持有者此版本于 2020 年 4 月 1 日发布。;https://doi.org/10.1101/2020.03.30.016485 doi:bioRxiv 预印本
神经系统疾病中的人参皂苷Rb1的进展
“所有草药的王”是人参,一种补品和药草(Tao et al。,2023)。传统中药将人参的效率归因于延长生命并补充重要能量(IM,2020年)。人参对神经系统疾病的治疗益处得到了广泛的临床前和临床数据的支持(Mancuso和Santangelo,2017年)。人参的活性成分包括皂苷,多糖,精油和多肽(Ha等,2007; Ni等,2022; Tao等,2023)。Ginsenosides由20(s) - 甲二二二醇和20(s) - dammarane类型的丙二醇糖蛋白组成(Zhou等,2019a)。Ginsenoside RB1(GSRB1)是一种高度流行的人参皂苷,用作主要的原帕纳二二醇皂苷(图1)(Kim等,2022; Ni等,2022)。GSRB1可用于治疗影响神经,心血管和内分泌系统的多系统疾病(Zheng等,2017; Zhou等,2019b; Gong等,2022)。GSRB1已被发现表现出几种生物学活性,尤其是在神经系统中。这些活性可以穿透血脑屏障并发挥神经保护作用,例如抗炎性,抗氧化剂,抗凋亡和抗嗜硫酸盐(Kim,2012; Kim等,2013; Ong等,2015; Zhou等,2015; Zhou等,2019b)。最近的研究表明,GSRB1可以抑制炎症,氧化应激和兴奋性毒性,减轻神经元损伤,并促进神经元细胞修复以治疗神经疾病(Kiefer和Pantuso,Pantuso,2003; Yang Je。等,2020; Shi等,2020)。等,2020; Shi等,2020)。这些发现表明GSRB1在治疗癫痫,阿尔茨海默氏病(AD)和帕金森氏病(PD)方面可能更有效。
红鸟广场 WellMed 慈善基金会老年活动中心
基金会以健康生活为目标,负责监督德克萨斯州和佛罗里达州一系列全国知名的老年活动中心的日常运营。其中一些中心由有价值的公私合作伙伴关系资助。老年活动中心向公众开放,为 60 岁或以上的老年人免费提供服务。该中心与达拉斯市公园和娱乐部老年计划部合作。该中心提供健康和保健计划、充实活动、特别活动、社交机会、竞技体育和特殊兴趣计划。
木工活动:安全提示 鸟舍建造计划
电钻基本上是一种自动螺丝刀——你按下一个按钮,它就会快速轻松地拧入螺丝。但是,由于它在技术上是一种“电动工具”,因此你应该遵循某些安全建议。使用电钻时,应该有一位负责任的成年人在场。固定好你的工件,使其不会滑动。如果可能,在你想要螺丝进入的地方钻一个小孔(称为“导向孔”),这样更容易拧入螺丝。在使用电钻之前,请确保钻头固定好,电线足够长(你可能需要延长线),并且你可以正确抓住它。拧入螺丝时,你需要对电钻施加适当的压力——确保你保持稳定,如果你用力过猛,不会从某物上掉下来。操作电钻时,宽松的衣服、宽松的袖子、珠宝和头发都可能造成危险。一如既往,戴上你的护目镜。6. 打磨块
KRAS Q61H 突变使癌细胞获得对 SHP2 抑制的耐药性
携带不同 KRAS 突变的癌细胞对 SHP2 抑制的敏感性也不同。《自然通讯》最近发表的一项研究揭示了携带 KRAS Q61H 突变的癌细胞对 SHP2 抑制剂(SHP2i)的潜在耐药机制。1这项研究表明,KRAS Q61H 突变通过将 KRAS 与 SHP2 介导的上游核苷酸交换因子(鸟嘌呤核苷酸交换因子 [GEF])/GTPase 活化蛋白 (GAP) 调控分离而使癌细胞对 SHP2i 产生耐药性,为治疗携带 KRAS Q61H 突变的癌症提供了新的见解。KRAS 是突变最常见的 RAS 亚型,是一种编码小 GTPase 转导蛋白的原癌基因。响应上游信号,KRAS 可以通过 GEF(例如 Son of Sevenless (SOS) 或 GAP)在无活性的二磷酸鸟苷 (GDP) 状态和活性的三磷酸鸟苷 (GTP) 状态之间切换。2 KRAS 突变主要发生在密码子 12、13 或 61,占 RAS 突变的 86%。特别是,谷氨酰胺 61 通过定位攻击水分子和稳定水解反应的过渡态,在催化过程中起直接作用。3,4 通常,突变的 KRAS 可通过影响 GAP 介导的 GTP 水解导致活性 GTP 结合的 KRAS 积累,从而导致 RAS – RAF – MEK – ERK 通路过度活化,并伴有不受控制的细胞增殖。4 KRAS 突变在许多人类癌症中很常见,尤其是胰腺癌、非小细胞肺癌和结直肠癌。值得一提的是,特定的 KRAS 突变可能导致肿瘤患者的不同预后和治疗反应。因此,KRAS 突变对癌症治疗研究人员提出了挑战。2,4,5 从历史上看,KRAS 一直被认为是“不可成药”的药物靶点,因为它不包含经典的可用于药物的小分子结合口袋。6 通过关闭致癌基因,已经开发出用于抗癌药物开发的间接和直接方法
基因表达的转录和转录法规
抽象转录和转录后调节是控制基因表达的一个基本过程,可以使细胞在维持稳态的同时适应环境变化。这种调节的破坏会导致各种遗传疾病,包括癌症和神经退行性疾病。本文的目的是检查转录和转录后调节的机制,及其对分子生物学和生物医学的影响。本文通过收集PubMed,ScienceDirect和NCBI数据库的数据使用文献综述方法。分析,以识别关键因素,例如启动子,增强子,消音器,RNA聚合酶II以及转录阶段,包括启动,伸长和终止,以限定,限制,尾声,裁缝和拼接。审查表明,转录调节始于涉及转录因子和RNA聚合酶II的预启用复合物的形成。在伸长过程中,RNA合成以高度的加工性进行。在转录后阶段,修饰,例如在5'末端添加7-甲基鸟苷,而在3'末端的聚腺苷酸化则增加了mRNA的稳定性。此外,剪接机制允许从单个基因形成不同蛋白质。该调节可确保基因表达在细胞要求的适当时间,位置和数量上发生。在转录后阶段,修饰,例如在5'末端添加7-甲基鸟苷和3'末端的聚腺苷酸化增加了mRNA的稳定性。剪接机制允许从单个基因形成不同蛋白质。该调节可确保根据细胞的需求在适当的时间,位置和数量上发生基因表达。抽象转录和转录后调节是控制基因表达的基本过程,可以使细胞在维持稳态的同时适应环境变化。该调节的疾病会引发各种遗传疾病,包括癌症和神经退行性疾病。撰写本文旨在检查转录和转录后调节的机制,及其对分子和生物医学生物学的影响。Div>使用文献审查方法编写文章,通过收集PubMed,ScienceDirect和NCBI数据库的数据。进行分析以识别主要要素,例如启动子,增强子,消音器,RNA聚合酶II以及转录阶段,包括启动,伸长和终止,以及转录后的转录机制,例如封盖,裁缝和固定。审查结果表明,转录调控始于涉及转录因子和RNA聚合酶II的预启示复合物的形成。在伸长过程中,RNA合成以高水平的处理。在转录后阶段,诸如5'结束时添加7-甲基鸟苷的修改以及3'结束时的多额质量增加了mRNA稳定性。剪接机制还允许从一个基因形成不同的蛋白质。该调节可确保根据细胞需求及时,位置和数量进行基因表达。
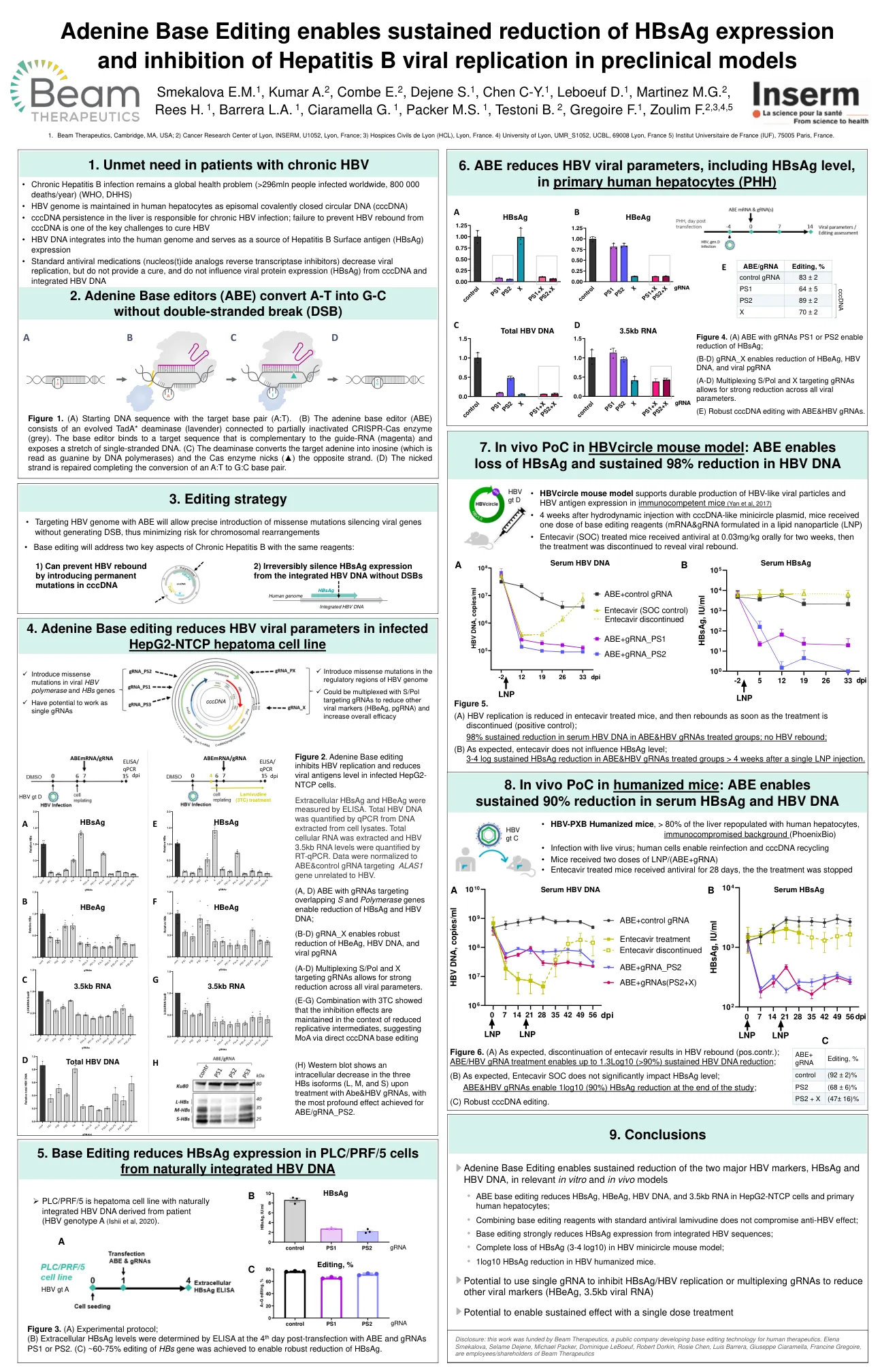
腺嘌呤碱基编辑能够在相关的体外和体内模型中持续降低两种主要的 HBV 标志物 HBsAg 和 HBV DNA
图 1. (A) 起始 DNA 序列,其中包含目标碱基对 (A:T)。(B) 腺嘌呤碱基编辑器 (ABE) 由进化的 TadA* 脱氨酶 (淡紫色) 和部分失活的 CRISPR-Cas 酶 (灰色) 组成。碱基编辑器与与向导 RNA (洋红色) 互补的目标序列结合,并暴露一段单链 DNA。(C) 脱氨酶将目标腺嘌呤转化为肌苷 (DNA 聚合酶将其读取为鸟嘌呤),Cas 酶切口 (▲) 另一条链。(D) 切口链被修复,完成从 A:T 到 G:C 碱基对的转换。
工程化的环状 ADAR 募集 RNA 可提高体内和体外 RNA 编辑的效率和保真度
基因组编辑工具,如锌指核酸酶、转录激活因子样效应核酸酶、CRISPR-Cas 系统和 CRISPR-Cas 衍生物(胞嘧啶和腺苷碱基编辑器),已广泛应用于基因组操作,并显示出它们的治疗潜力。除了基因组编辑技术之外,RNA 碱基编辑技术也得到了开发 1 。由于 RNA 编辑是可逆的、可调控的,并且不会导致基因组的永久性改变,因此它在治疗应用中可能具有一定的优势。对于腺苷的 RNA 编辑,作用于 RNA 的腺苷脱氨酶 (ADAR) 家族的成员,如 ADAR1(异构体 p110 和 p150)和 ADAR2(参考文献 2、3),已被设计用于将腺苷 (A) 精确转化为肌苷 (I) 1 。 ADAR1/2 的催化底物是双链 RNA,ADAR1/2 的脱氨酶结构域负责 A 到 I 的 RNA 编辑 4、5。肌苷被识别为鸟苷 (G),并在随后的细胞翻译过程中与胞苷 (C) 配对 3。为了实现靶向 RNA 编辑,ADAR 蛋白(或其脱氨酶结构域 ADAR DD)已与多种 RNA 靶向模块融合,例如 λ N 肽 6 – 8、SNAP 标签 9 – 13 和 Cas13 蛋白 14。此外,可以利用带有 R/G 基序的工程向导 RNA 与异位表达的 ADAR1 或 ADAR2 蛋白偶联来实现靶向 RNA 编辑 15 – 18。然而,外源编辑酶的异位表达与几个问题有关,包括基因组和/或 RNA 转录物的大量全局脱靶编辑 19 – 23 、免疫原性 24 – 27 、致癌性 28 – 30 和递送障碍 24 。 Stafforst 团队和我们自己报告的两种 RNA 编辑技术 RESTORE 31 和 LEAPER 32 利用内源性 ADAR 对 RNA 进行可编程编辑,而无需引入