XiaoMi-AI文件搜索系统
World File Search System(Nirmatrelvir; Ritonavir)产品专着
由于其作用机理,Fabhalta的使用可能使人易患因封装细菌引起的严重感染,例如肺炎链球菌和奈瑟氏菌脑膜炎(请参阅7个警告和预防措施,严重的警告,由包围细菌引起的严重感染)。•遵守最新的国家免疫咨询委员会(NACI)建议或区域实践指南针对封装细菌的疫苗接种指南,特别是脑膜炎奈瑟氏菌和肺炎链球菌的奈瑟氏菌,对辅助缺陷的患者。•必须在启动Fabhalta之前至少2周,至少2周,必须对封装的细菌进行疫苗接种疫苗,特别是脑膜炎和肺炎链球菌,除非延迟Fabhalta疗法的风险超过产生严重感染的风险。•疫苗接种后不到2周开始接受Fabhalta治疗的患者必须接受适当的预防性抗生素治疗,直到接种后2周。•疫苗接种减少但不会消除严重感染的风险。监测患者的
truqaptm产品专着
•应使用经过验证的测试的一个或多个PIK3CA/AKT1/PTEN遗传改变,应选择一种激素受体(HR)阳性,HER2阴性晚期乳腺癌进行TRUQAP治疗。•启动TRUQAP之前的葡萄糖水平异常水平的患者中的葡萄糖水平纠正。由于TRUQAP引起高血糖的潜力,应在治疗前和治疗期间定期进行禁食血糖(FG)水平和血红蛋白A1C(HBA1C)的测试(请参阅4.2建议的剂量和剂量调整,高血糖症和7 Warnings和7 Warnings和7 Warnings and Presnions and oferage and Endricrice,Endribrism和Metabolism and Metabolism and Metabirism和Metabibilism。•在预/绝经期妇女中,Truqap Plus Fulvestrant应与黄体生成激素释放激素(LHRH)激动剂结合在一起(请参阅4.2建议的剂量和剂量调整)。•同时使用强和中等的CYP3A4抑制剂会增加capivasertib浓度,这可能会增加TRUQAP毒性的风险。当与强和中等的CYP3A4抑制剂同时使用时,应降低TruQAP剂量(请参阅4.2建议的剂量和剂量调整以及9种药物相互作用)。•不建议将TRUQAP与强CYP3A4诱导剂一起使用(请参见9种药物相互作用)。
[产品专着模板 - 标准]
由于其作用机理,Fabhalta的使用可能使人易患因封装细菌引起的严重感染,例如肺炎链球菌和奈瑟氏菌脑膜炎(请参阅7个警告和预防措施,严重的警告,由包围细菌引起的严重感染)。•遵守最新的国家免疫咨询委员会(NACI)建议或区域实践指南针对封装细菌的疫苗接种指南,特别是脑膜炎奈瑟氏菌和肺炎链球菌的奈瑟氏菌,对辅助缺陷的患者。•必须在启动Fabhalta之前至少2周,至少2周,必须对封装的细菌进行疫苗接种疫苗,特别是脑膜炎和肺炎链球菌,除非延迟Fabhalta疗法的风险超过产生严重感染的风险。•疫苗接种后不到2周开始接受Fabhalta治疗的患者必须接受适当的预防性抗生素治疗,直到接种后2周。•疫苗接种减少但不会消除严重感染的风险。监测患者的
Arimidex®产品专着
儿科(<18岁):加拿大卫生部未授权儿科使用Arimidex。老年病(> 65岁):老年患者无需剂量变化(请参见1个适应症)。肝损伤患者的剂量修饰:尽管由于酗酒而患有肝硬化的受试者的肛门曲霉的明显口服清除率降低了,但血浆酸唑叠氮的浓度均在没有肝病学科的所有临床试验的范围内。因此,尽管应监测患者的副作用,但对于轻度到中度肝损伤的患者建议不建议剂量变化。arimidex尚未在严重的肝损伤患者中研究。在服用Arimidex(10.3药代动力学)之前,应仔细考虑对此类患者的潜在风险/益处。针对肾功能不全的患者的剂量修饰:肾脏损伤患者无需改变剂量。在这些患者服用Arimidex之前,仍应考虑对严重肾脏损伤患者的潜在风险/益处(10.3药代动力学)。
nivolumab-relatlimab(临时专着)
nivolumab-relatlimab是两种完全人源化的IgG4单克隆抗体的固定剂量组合:Nivolumab:Nivolumab(一种程序性细胞死亡1(PD-1)免疫检查点抑制剂)和Relatlimab(淋巴细胞激活基因3(lag-3)免疫检查点Inmune Checkpoint Inbimab(淋巴细胞激活基因3(LAG-3)。PD-1途径是一个免疫系统检查点,肿瘤细胞可能会利用该检查点,以避免主动的T细胞监视。通过阻断PD-1受体与PD-1和PD-2配体的结合,Nivolumab在肿瘤微环境中重新激活了肿瘤特异性的细胞毒性T淋巴细胞,并将其重新降低抗肿瘤活性。同样,LAG-3是一种免疫检查点受体蛋白,在负调控T细胞功能并提供肿瘤逃脱的肿瘤中具有重要作用。通过与滞后T细胞受体结合并阻止其与配体的相互作用,Relatlimab降低了对免疫反应的滞后-3途径抑制,并促进T细胞增殖和细胞因子分泌。与单独的任何一种抗体的活性相比,Nivolumab和Relatlimab的组合会导致T细胞激活增加。1-4
talazoparib(talzenna)国家药物专着2024年9月
•PARP抑制剂疗法已成为HER2阴性局部晚期或转移性乳腺癌患者的标准,在接受化学疗法和内分泌治疗(如果激素受体阳性疾病)进行后,具有生殖线BRCA 1/2突变。•还建议对具有体细胞BRCA 1/2突变的转移性HER2阴性乳腺癌患者或其生殖伴侣,PALB2突变一旦患者在化学疗法和内分泌治疗方面进展(如果激素 - 感染者阳性)。•Olaparib是一种PARP抑制剂,在Talazoparib之前接受了FDA批准。vha肿瘤学乳腺癌途径包括Olaparib作为首选PARP抑制剂。talazoparib是一次每天一次的表述,而每天两次服用Olaparib,这可能会影响患者的依从性。•由于Olaparib进入了VA乳腺癌途径,因此塔拉唑帕里可以在乳腺癌中使用非格式。应通过非格式化过程可用于Olaparib依从性问题的患者。•同源重组修复(HRR)是双链断裂的DNA修复过程,导致DNA交联,这可能是基于铂的化学疗法引起的。缺乏HRR的细胞对PARP抑制剂和含铂的化学疗法的敏感性。患有耐HRR基因变异的转移性cast割前列腺癌患者可能会对PARP抑制剂疗法反应。
Fluad- [产品专着模板 - 标准]
在疫苗接种后4天内,最常见的局部不良事件是注射部位疼痛,其次是注射部位的温度(“温暖”或“热”)和红斑。在接受MF59辅助疫苗的受试者中,局部注射部位反应(注射部位的疼痛和温度)比接受非副疫苗的受试者更频繁。在Fluad®组中,疼痛的频率为26%,比较组中的疼痛频率为14%。在Fluad®组中,注射位点的温度为18%,比较组为11%。征求的局部反应通常具有轻度或中等强度,通常在2-3天内解决3%或更少的受试者报告严重的局部反应。
Sotatercept(Winrevair)国家药物专着...
•其他感兴趣的不利事件o增加出血风险:与恒星的安慰剂相比,Sotatercept与出血增加有关。过多的出血主要被视为鼻脑和牙龈出血,并且发生的情况是不论使用前列环素或抗血栓形成疗法而发生的。据报道,在Stellar中接受Sotatercept vs.安慰剂的越来越多的患者(4%比1%)。严重出血的患者更有可能接受前列环素治疗,抗血栓形成或血小板计数较低。o血小板减少症:Sotatercept与血小板减少症与安慰剂的风险增加有关。血小板计数在25%的Sotatercept和16%的接受安慰剂治疗的患者中降至正常水平以下。血小板计数少于50,000/m 3的Sotatercept患者中有3%的患者;所有这些患者都接受了proprostenol。o红细胞增多:血红蛋白> 2g/dL高于正常(ULN)的2g/dL发生在15%的索特塔尔接受患者中。严重的红细胞增多症可能会增加血栓栓塞事件或过度视力综合征的风险。
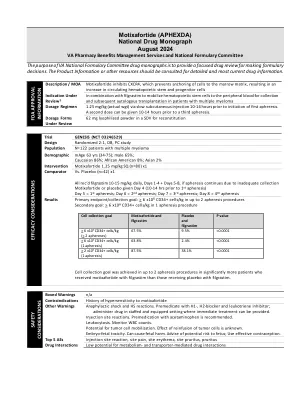
motixafortide(Aphexda)国家药物专着...
PBSC预期自体移植。很难确定一种药物是否比另一种药物更有效。尽管患者人群相似,但标准诱导方案发生了变化,这证明了在Plerixafor和MotixafortiDE试验中接受过利纳度胺的人群证明的。通过比较导致批准的临床试验,它不考虑替代剂量剂量策略,例如适应风险的动员策略。2。干细胞动员有可能减少分离过程并优化细胞收集。由于PBSC收集不足,应将它们用于HSCT设置。3。motixafortide可能对对Plerixafor的过敏或过敏和患者有用。
letermovir(prevymis):凯尼(Kidney)移植药物专着Addendumjune 2024
Study Demographics Efficacy results Russo et al., 2024 3 Phase 3, DB, placebo-controlled RCT (2:1) Inclusion: adult D+/R- HSCT recipients who had received up to 100 days of LET prophylaxis and were high-risk for CMV based on donor properties, stem cell source, receipt of anti- thymocyte globulin or alemtuzumab or graft vs. host disease (GVHD)需要持续的皮质类固醇排除:严重的肝病,终末期肾脏疾病,与其他抗CMV药物的治疗(在前7天内),CMV末端疾病的史或在随机治疗前进行CMV治疗的CMV治疗:每天480mg(IV或PO),如果要订立480mg(IV或PO)。 a)主要结果:失败:从第14周(100天)到第28周(200天)临床意义的CMV疾病*次要终点:第38周CMV疾病,发作CMV疾病的时间,安全性,耐药性



![[产品专着模板 - 标准]](/simg/f/fa2ce7285c01d530b4c58cbfc552d61ef7db933c.webp)



![Fluad- [产品专着模板 - 标准]](/simg/e/e4ccccaa261cd970c867343dbc61c6e79a4bf326.webp)