XiaoMi-AI文件搜索系统
World File Search System体内RECB的单分子成像揭示了DNA大肠杆菌中DNA双链破裂修复的动力学
摘要:近年来,由于其治疗潜力和多功能性在药物化学中,有机苯苯甲酸盐引起了很大的关注。在这里,我们报告了5-苯基碳酰甲基戊烯基硒酸(SELSA-2)抑制的机制,这是特征良好的组蛋白脱乙酰基酶抑制剂suberoylanilide suberoylanilide hydroxamic的类似物(Sahavorinostat)。我们表明,组蛋白脱乙酰基酶6和10可以促进硒氰酸酯水解产生硒酸盐阴离子,并且我们通过可逆形成二苯胺来调节抑制活性,探索硒的氧化还原化学。组蛋白脱乙酰基酶6的2.15Å分辨率晶体结构与SELSA-2结合结构,最终证明它不是硒氰酸酯,而是硒酸盐阴离子,这是负责酶抑制的活性药理。
tng260:一种新型,口服活性的corest选择性脱乙酰基酶抑制剂,用于治疗STK11-突变体癌症
tng260:一种新型,口服活性的corest选择性脱乙酰基酶抑制剂,用于治疗STK11-突变体癌症
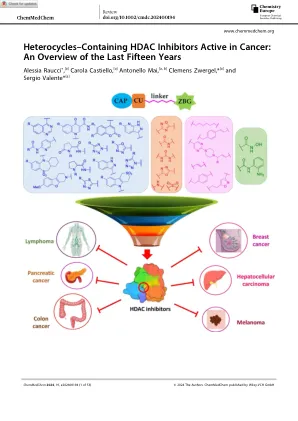
含杂环的 HDAC 抑制剂对癌症有效
HDAC 是一类催化组蛋白尾部赖氨酸残基乙酰基去除的酶,从而导致染色质重塑。[3] 具体而言,乙酰基的去除会导致染色质凝聚,这是由于去乙酰化的组蛋白胺的氮的正电荷与带负电荷的 DNA 链之间的相互作用。[4] 这种相互作用阻碍了转录因子的进入,最终导致转录抑制。因此,HDAC 是调控基因表达的重要酶。[5] 在 HDAC 底物中,不仅有组蛋白尾部的赖氨酸,还有非组蛋白,如转录因子、细胞骨架蛋白、分子伴侣和核输入因子,涉及广泛的生物学过程。[6]
剥削1型毒素 - 抗毒素系统作为乙酰基菌群中基因组编辑的诱导型反选择标记
摘要:先前已使用基于CRISPR的诱变方法获得了厌氧甲基菌质细菌中的靶向突变。在这项研究中,将来自Callanderi的RELB家庭毒素放置在甲型苯乙烯敏感启动子的控制之下,形成可诱导的反选择系统。该诱导系统与非复制性整合诱变载体相结合,以在limosum b2的Eubacterium B2中创建精确的基因缺失。这项研究中针对的基因是编码组氨酸生物合成基因HISI,甲醇甲醇转移酶和类cor我蛋白MTAA和MTAC的基因,以及编码MTTB-氨基甲基转移酶的MTCB,先前显示出MTTB-FAMILY甲基转移酶。HISI内的有针对性的缺失带来了预期的组氨酸成可营养,MTAA和MTAC的缺失都废除了甲醇的自养生长。MTCB的缺失被证明是消除了Limosum在L-肉碱上的生长。 在隔离转化菌落的初始选择步骤之后,仅需要一个单个诱导步骤才能获得所需靶标的突变菌落。 可诱导的反选择标记和非复制综合质粒的组合可以快速地编辑大肠杆菌。MTCB的缺失被证明是消除了Limosum在L-肉碱上的生长。在隔离转化菌落的初始选择步骤之后,仅需要一个单个诱导步骤才能获得所需靶标的突变菌落。可诱导的反选择标记和非复制综合质粒的组合可以快速地编辑大肠杆菌。
使用碱性单细胞凝胶电泳(SCGE)彗星测定的氧化DNA损伤以及N-乙酰基半决赛的保护作用
Zearalenone(ZEN)是一种由几种在谷物和农产品中发现的镰刀菌产生的非甾体雌激素霉菌毒素。Zen与农场动物和人类的霉菌毒性有关。ZEN的毒性作用众所周知,但是尚未确定碱性彗星测定法评估Zen诱导的Chang肝细胞中氧化DNA损伤的能力。这项研究的第一个目的是评估彗星测定法测定Zen Toxin诱导的细胞毒性和DNA大坝的程度,第二个目的是研究N-乙酰半胱氨酸酰胺(NACA)保护细胞以保护细胞免受Zen诱导的毒性的能力。在彗星测定中,通过量化尾部范围矩(TEM;任意单位)和尾部长度(TL;任意单位)来评估DNA损伤,这些损伤用作SCGE中DNA链断裂的指标。通过抑制细胞增殖并诱导氧化DNA损伤,介导Zen在变肝细胞中的细胞毒性作用。增加ZEN的集中度增加了DNA损伤的程度。用Zen毒素治疗后,DNA迁移的程度和尾部的细胞百分比显着增加(P <0.05)。与高浓度的Zen毒素(250 p m)的细胞治疗相比,用低浓度的Zen毒素(25 p m)处理Zen毒素(25 p m)的治疗诱导的DNA损伤水平相对较低。氧化DNA损伤似乎是Chang肝细胞中Zen诱导的毒性的关键决定因素。在暴露于任何浓度的ZEN之前先用NACA预先处理细胞时,观察到细胞溶解性的显着降低和氧化DNA损伤。我们的数据表明ZEN在Chang肝细胞中诱导DNA损伤,NACA的抗氧化活性可能有助于通过消除氧化应激减少Zen诱导的DNA损伤和细胞毒性。
组蛋白脱乙酰基酶(HDAC)抑制剂 - valproic Acid将人黑色素瘤细胞敏感到达卡巴嗪和PARP抑制剂
摘要:文明疾病被定义为影响很大一部分人群的非传染性疾病。此类疾病的例子是抑郁症和心血管疾病。重要的是,世界卫生组织警告说这两者都会增加。此叙述性评论旨在根据现有文献总结有关CVD和抑郁症的可测量风险因素的可用信息。本文回顾了抑郁症和心血管疾病共存的流行病学和主要危险因素。作者强调,有抑郁症与心血管疾病之间有联系的证据。在这里,我们重点介绍了抑郁症和心血管疾病的常见危险因素,包括肥胖,糖尿病和身体不活动,以及预防和治疗CVD在预防抑郁症和其他精神疾病中的重要性。相反,有效的CVD治疗也可以帮助预防抑郁症并改善心理健康结果。似乎建议出于心脏原因对患者进行抑郁症的筛查测试。重要的是,在接受情绪障碍治疗的患者中,值得控制CVD风险因素,例如,在常规就诊期间检查血压和脉搏。也值得关注CVD患者的心理状况。这项研究强调了跨学科合作的重要性。
探索有效氢存储的高级纳米结构和功能材料:关于机制的理论研究,吸附proc
氢是由于其高能量密度和零碳排放而导致可再生能源存储和运输的有前途的候选者。其实际应用面临与安全,有效的存储和释放系统有关的挑战。本评论文章研究了用于氢储存的高级纳米结构材料,包括金属乙酰基和氰化物配合物,B,N掺杂的γ-graphyne纳米管(γ-GNT),磷化锂双螺旋和NI-Formated Concobon-Cobon-Coarbon基簇。密度功能理论(DFT)计算用于分析结合能,热力学稳定性和吸附机制。ni装饰的C 12 N 12纳米群体表现出增强的储存能力,具有良好的N-(μ-Ni)-n构造的最高八个H 2分子结合。磷化锂双螺旋在一个稳定的半导体框架内显示出9.6 wt%氢气的潜力。在硼掺杂位点使用OLI 2的γ -GNT的功能显着提高了存储潜力,从而实现了实用应用的最佳氢结合能。此外,通过贵重气体插入稳定的金属乙酰基和氰化物配合物显示热力学上有利的氢吸附。这些结果突出了这些功能化纳米结构的潜力,可以实现高容量,可逆的氢存储。γ-GNT提供高表面积和可调电子特性,非常适合通过杂原子掺杂增强物理吸附。磷化锂双螺旋促进了通过不饱和锂中心的库巴斯样化学吸附。这些材料代表这项研究中的纳米结构,例如γ-图纳米管(γ-GNT),磷化锂双螺旋,金属乙酰基和氰化物络合物以及基于NI染色的碳基簇,是基于其具有互补氢充气机制的能力,包括物理学和化学能力。金属乙酰基和氰化物配合物通过电荷转移和共轭框架稳定氢吸附,而NI装饰的簇结合了极化诱导的物理吸附。
PAA1基因在酿酒酵母中的褪黑激素生物合成中的作用:搜索新的芳基烷基胺N-乙酰基转移酶
摘要:最近,发酵饮料中褪黑激素的存在与酒精发酵过程中的酵母代谢有关。褪黑激素最初被认为是脊椎动物的松果腺的独特产物,在广泛的无脊椎动物,植物,细菌和真菌中也被鉴定出来。这些发现带来了研究褪黑激素在酵母中的功能以及其合成的机制的挑战。但是,提高发酵饮料中这种有趣分子的选择和生产的必要信息是披露代谢途径中涉及的基因。到目前为止,仅提出了一个基因,该基因参与了酿酒酵母中的褪黑激素的产生,PAA1,一种多胺乙酰基转移酶,这是脊椎动物的Aralkylamine N-乙酰基转移酶(AANAT)的同源物。在这项研究中,我们使用不同的蛋白质表达平台评估了不同可能底物的生物转化,例如5-甲氧氨基胺,色氨酸和5-羟色胺,评估了PAA1的体内功能。此外,我们通过结合全局转录组分析和使用强大的生物信息学工具来预测S. cerevisiae中的Aanat的类似域,从而扩展了对新的N-乙酰基转移酶候选的搜索。候选基因的AANAT活性通过大肠杆菌中的过表达来验证,因为奇怪的是,该系统证明了比其自己宿主的酿酒酵母中的过表达更高的差异。我们的结果证实了PAA1具有乙酰化不同的芳基胺的能力,但AANAT活性似乎不是主要的乙酰化活性。我们还证明,PAA1P并不是这种AANAT活性的唯一酶。我们对新基因的搜索在酿酒酵母中检测到HPA2是一种新的芳基烷基胺N-乙酰基转移酶。这是第一个报告,清楚地证明了该酶参与AANAT活性。
靶向帽子,HDAC和BRD的小分子
过去十年的研究证据表明,表观遗传调节机制通过肿瘤的发展和预后运行。因此,针对表观遗传调节的小分子化合物已成为癌症治疗药物发展的研究热点。根据发生肿瘤时组蛋白乙酰化的明显异常,这表明组蛋白乙酰化修饰在肿瘤发生过程中起重要作用。目前,作为一种新的潜在抗癌药物,靶向组蛋白乙酰化调控酶或蛋白质(例如组蛋白脱乙酰基酶(HDAC)),组蛋白乙酰基转移酶(HATS)和溴化物瘤(BRDS)的许多活性小分子已开发出来恢复平均成绩替代的成替代剂量。在这篇综述中,我们将重点介绍肿瘤发生过程中组蛋白乙酰化水平的变化,以及针对癌症治疗中组蛋白乙酰化的小分子的可能的药理学机制。