XiaoMi-AI文件搜索系统
World File Search System酪氨酸激酶抑制剂耐药的克隆进化
中东呼吸道综合征冠状病毒(MERS-COV)感染会导致人类致命的肺部炎症性疾病。相反,骆驼和蝙蝠是主要的储层宿主,耐受的MERS-COV复制而不患有临床疾病。在这里,我们从MERS-COV康复的骆驼中分离了宫颈淋巴结(LN)细胞,并用两种不同的病毒菌株(进化枝B和C)脉冲它们。病毒复制,但安装了细胞免疫反应。让人联想的Th1反应(IFN-G,IL-2,IL-12),并伴随着抗病毒反应的明显且短暂的峰值(I型IFNS,IFNS,IFN-L 3,ISGS,ISGS,PRRS和TFS)。重要的是,炎症细胞因子(TNF-A,IL-1 B,IL-6,IL-8)的表达或膨胀成分(NLRP3,CASP1,Pycard)的表达被抑制。讨论了IFN-L 3在骆驼物种中对平衡量弹性过程以及桥接先天和适应性免疫反应的作用。我们的发现阐明了有关在没有临床疾病的情况下如何控制MERS-COV的关键机制。
沉香叶茶康普茶 (Aquilaria malaccensis Lamk.) 的抗氧化活性和乙酰胆碱酯酶抑制剂
痴呆症目前仍然是一个全球性的健康问题,全球估计有5520万人患有痴呆症。最常见的痴呆症类型之一是阿尔茨海默病,因为它占痴呆症病例的 60-80%。日惹是印度尼西亚阿尔茨海默病发病率最高的地区。阿尔茨海默病是一种渐进性的神经退行性疾病,由大脑中形成β-淀粉样斑块引起,会破坏神经系统。根据胆碱能理论,斑块的形成是由于酶乙酰胆碱酯酶 (AChE) 的存在。通过药物治疗方法,抑制AChE酶可以改善认知功能并抑制阿尔茨海默病的进展。同时,抗氧化活性也被证明可以预防阿尔茨海默病。沉香叶(Aquilaria malaccensis Lamk.)是一种富含酚类化合物的植物,具有很强的抗氧化活性。然而,并非所有的酚类化合物都能被人体消化,因此需要通过发酵进行简化。研究表明,将沉香茶制成康普茶可以使其中的酚类含量比普通沉香叶茶中的酚类含量高出两倍。然而,沉香叶康普茶作为阿尔茨海默病替代疗法的抗氧化和乙酰胆碱酯酶抑制剂活性尚未被研究过。基于此,本研究旨在通过薄层色谱(TLC)和气相色谱-质谱(GC-MS)分析测试沉香叶茶康普茶的抗氧化活性、乙酰胆碱酯酶抑制剂和植物化学成分。该研究的阶段包括沉香叶的准备、康普茶发酵、感官测试、抗氧化剂测试、乙酰胆碱酯酶抑制测试和植物化学概况(薄层色谱法和气相色谱-质谱法)。本研究结果表明,沉香叶康普茶提取物具有不同的抗氧化活性,抗氧化活性最好的是康普茶发酵7天的乙酸乙酯提取物,IC50值为2.68µg/mL。沉香叶茶的康普茶提取物通过将癸酸乙酯化合物与 4M0E 蛋白结合,在计算机中具有 AChE 抑制活性。沉香叶康普茶乙酸乙酯提取物的植物化学概况表明,薄层色谱试验中存在黄酮类和酚类化合物,而 GC-MS 试验表明,角鲨烯是提取物中检测到的面积百分比最高的化合物。
酪氨酸激酶抑制剂联合 PD-1 治疗的疗效和安全性...
肝细胞癌 (HCC) 是一种高发癌症,在全球癌症死亡原因中位居第三 ( 1 )。尽管 HCC 监测方案不断进步,但由于缺乏早期临床表现,大约 80% 的患者在确诊时已是中期或晚期,从而错过了根治性切除的机会。尽管如此,HCC 有多种治疗方法,具体取决于患者的临床情况、肿瘤分期和保留的肝功能 ( 2 )。经动脉化疗栓塞术 (TACE) 是针对中期和晚期 HCC 的推荐局部治疗 ( 3 )。TACE 不仅可以与化疗相结合,还可以与肝脏肥大诱导方法相结合 ( 4 )。然而,TACE 的有效性随着手术次数的增加而降低,每次手术后都会观察到更高的疾病进展率 ( 1、3、5、6 )。这种现象被称为“ TACE 难治性”,是由日本肝病学会和日本肝癌研究组于 2014 年提出的一个新概念 ( 7 , 8 )。从那时起,它作为晚期 TACE 难治性肝细胞癌的治疗选择引起了广泛关注。为了提高 TACE 的疗效,人们尝试了各种联合肝脏治疗和全身治疗,例如消融、放疗、酪氨酸激酶抑制剂 (TKI) 和免疫疗法 ( 9 )。索拉非尼和仑伐替尼是晚期肝细胞癌的一线治疗药物,但其生存获益有限 ( 10 )。针对程序性死亡-1 (PD-1) 的免疫检查点抑制剂 (ICI) 在 CheckMate040 和 KEYNOTE-224 等 I/II 期临床试验中已显示出良好的效果 ( 11, 12 )。然而,在 CheckMate 459 和 KEYNOTE-240 两项 III 期试验中,抗 PD-1 疗法并未显示出优于标准治疗 ( 13 , 14 )。最近的研究推荐将抗 PD-(L)1 药物与抗 VEGF 抗体或 TKI 联合治疗作为晚期 HCC 的一线治疗,因为它具有良好的疗效。TACE 诱导的肿瘤组织坏死引起的肿瘤抗原释放可能会增强肿瘤特异性免疫反应。此外,TACE 后的缺氧反应可以进一步刺激肿瘤血管生成 ( 15 )。考虑到这些因素,将 TACE 与 TKI 和 PD-1 抑制剂联合使用有望在 TACE 难治性晚期 HCC 病例中取得积极成果 ( 16 )。上述因素表明,将 TACE 与 TKI 以及 PD-1 抑制剂联合使用可在 TACE 难治性晚期 HCC 病例中取得良好效果。结合 TACE、TKI 和 PD-1 抑制剂的治疗方法可能会在治疗晚期
新型 Siglec-15-Sia 轴抑制剂通过靶向 miR-6715b-3p 和致癌基因导致结直肠癌细胞死亡
Siglecs 是众所周知的癌症免疫治疗靶点。目前的检查点抑制剂疗效有限,因此需要针对 Siglec-15 等靶点的新型疗法。目前,针对 Siglec-15 的小分子抑制剂尚未与涉及 CRC 进展的 microRNA 的特征性调控机制一起进行探索。因此,体外阐明了针对 Siglec-15 的小分子抑制剂,并研究了 microRNA 介导的抑制剂作用。我们的研究结果表明,SHG-8 分子对细胞活力、迁移和菌落形成具有显着的细胞毒性,IC 50 值约为 20µM。SHG-8 暴露在体外诱导 SW480 CRC 细胞晚期凋亡。值得注意的是,miR-6715b-3p 是高通量测序中上调最多的 miRNA,这也通过 RT-qPCR 进行了验证。 MiR-6715b-3p 可能调节 PTTG1IP,这是一种潜在的致癌基因,已通过 RT-qPCR 和计算机模拟分析进行了验证。此外,分子对接研究显示 SHG-8 与 Siglec-15 结合口袋相互作用,结合亲和力为 -5.4 kcal/mol,突出了其作为小分子抑制剂的作用。重要的是,Siglec-15 和 PD-L1 在相互排斥的癌细胞群中表达,表明与 PD-L1 拮抗剂联合治疗的潜力。
芳香酶抑制剂:从艺术状态到临床开放问题的旅程
乳腺癌是女性死亡的主要原因。在治疗这种疾病方面已取得了巨大进步,芳香酶抑制剂(AIS)已被认为是基石。它们的特征是高效率和低毒性。作者回顾了可用文献和定义的状态AI管理。这项研究旨在帮助临床医生在日常临床实践中同样权衡患者的需求和疾病控制率的需求。今天,AIS在治疗激素受体阳性乳腺癌中起着核心作用。 在这项研究中,专家小组回顾了有关AIS使用的文献,讨论了它们在乳腺癌的各个方面的使用,从乳腺癌前和绝经后早期乳腺癌到转移性乳腺癌,以及其有关效率和毒性的管理。 鉴于在改善日常临床实践中的生存方面取得的出色结果,临床医生需要解决他们对治疗持续时间的担忧以及对骨骼健康,心血管系统和代谢的不利影响。 目前,除了癌症治疗外,患者的参与对于改善依从性和支持患者的生活质量至关重要,尤其是在选定的患者中,例如接受扩展辅助疗法或与靶向疗法结合的患者。 对现代技术的描述提供了为这一重要目标做出贡献的描述。今天,AIS在治疗激素受体阳性乳腺癌中起着核心作用。在这项研究中,专家小组回顾了有关AIS使用的文献,讨论了它们在乳腺癌的各个方面的使用,从乳腺癌前和绝经后早期乳腺癌到转移性乳腺癌,以及其有关效率和毒性的管理。鉴于在改善日常临床实践中的生存方面取得的出色结果,临床医生需要解决他们对治疗持续时间的担忧以及对骨骼健康,心血管系统和代谢的不利影响。目前,除了癌症治疗外,患者的参与对于改善依从性和支持患者的生活质量至关重要,尤其是在选定的患者中,例如接受扩展辅助疗法或与靶向疗法结合的患者。对现代技术的描述提供了为这一重要目标做出贡献的描述。
非甾体CYP17A1抑制剂:发现和评估
摘要:Pistacia lentiscus L.(PLL)已在传统医学中使用了几个世纪。PLL衍生物的抗菌生物分子的丰富度可以代表用于口服感染的化学配方剂的替代品。本综述总结了对PLL精油(EO),提取物和乳胶树脂的抗菌活性的知识。结果表明,PLL多酚提取物的潜力导致了科学兴趣的增加。实际上,这些提取物比其他PLL衍生更有效。关于抑制牙周病原体和白色念珠菌的正面发现,以及抗氧化活性以及炎症反应的减少,表明提取物在预防和/或逆转内障碍性障碍中。牙膏,漱口水和局部输送设备可能在这些口腔疾病的临床管理中有效。
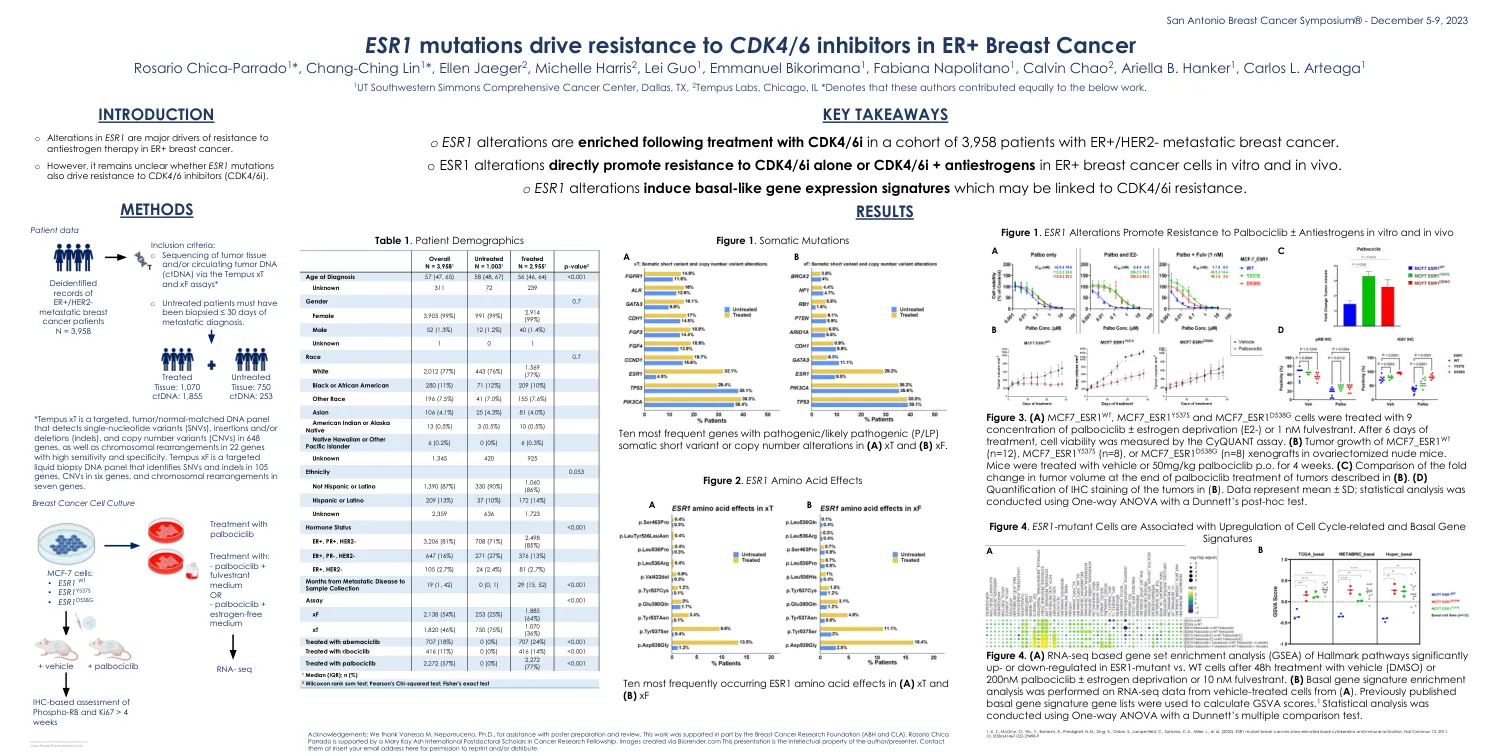
ESR1突变驱动对ER+乳腺癌中CDK4/6抑制剂的抗性
图3。(a)MCF7_ESR1 WT,MCF7_ESR1 Y537S和MCF7_ESR1 D538G细胞用9浓度的palbociclib±雌激素剥夺(E2-)或1 nm fulvesterant处理。治疗6天后,通过曲面测定法测量细胞活力。(b)MCF7_ESR1 WT的肿瘤生长(n = 12),MCF7_ESR1 Y537S(n = 8)或MCF7_ESR1 D538G(N = 8)异种移植物在卵巢肌切除术中。小鼠用车辆或50mg/kg Palbociclib P.O.持续4周。(c)在(b)中描述的肿瘤处理结束时肿瘤体积的折叠变化的比较。(d)(b)中肿瘤的IHC染色定量。数据代表平均值±SD;使用Dunnett的事后测试使用单向方差分析进行统计分析。
ACR-2316:一种新型强效、选择性 WEE1/PKMYT1 抑制剂,采用 Acrivon Predictive Precision Pr 合理设计,具有优异的单药活性
这里我们描述了 Acrivon 发现的 ACR-2316,它是一种强效、选择性 WEE1/PKMYT1 抑制剂,临床前研究表明其单药活性优于基准抑制剂。该化合物是使用 AP3 专门设计的,通过平衡抑制 PKMYT1 来克服 WEE1 特异性抑制的局限性,我们的 AP3 平台发现这是 WEE1 抑制剂诱导的主要耐药机制。通过结构引导的药物设计,我们实现了对 WEE1 和 PKMYT1 的精确选择性,确保了主要基于机制的可逆性不良事件。在与基准临床分子的头对头临床前研究中,ACR-2316 与目前的临床 WEE1 或 PKMYT1 抑制剂相比表现出更优异的效力和活性。正在进行的 ACR-2316 单药疗法临床试验的患者给药已经开始,旨在评估 ACR-2316 的安全性和耐受性。
单个中心案例系列免疫检查点抑制剂
结果:在2011年至2023年之间,在亨斯曼癌症研究所接受ICIS治疗的3744例患者中有18名证实了ICI诱导的T1DM(0.48%)。十一名患者中有11例接受了抗PD1单药治疗,4例接受了抗PD1加化学疗法或靶向治疗,3例接受了ipilimumab和nivolumab。平均发作时间为218天(范围22-418天)。患者在诊断前2-3周内的血清葡萄糖突然升高。16(89%)出现糖尿病性酮症酸中毒。12例患者中有3例患有T1DM相关的自身抗体阳性。所有T1DM患者通过随访均依赖于胰岛素。中位随访的21.9个月(范围8.4-82.4),黑色素瘤组中没有患者进展或死于疾病。在黑色素瘤组中,最佳反应是2个完全反应,在主动治疗时有2个部分反应。辅助组中没有任何疾病复发。基线血液的蛋白质组学分析表明,ICI诱导的T1DM队列中的低频率(IL-6,OSMR)标记和高代谢(GLO1,DXCR)标记。